-
Hintergrund der Erfindung
-
Extrakorporale
Photopherese ist ein Verfahren, bei dem 8-Methoxypsoralen (8-MOP),
eine natürlich vorkommende
lichtempfindliche Verbindung, zwei Stunden vor der Behandlung oral
verabreicht wird; Blut wird dann vom Patienten abgenommen, mit Gerinnungshemmungsmittel
versetzt und die weißen
Blutzellen durch Zentrifugation getrennt und als eine an Leukozyten
angereicherte Fraktion gesammelt. Diese 8-MOP enthaltenden Leukozyten
werden dann mit Ultraviolett-A-Licht (UVA) bestrahlt, das das 8-MOP
an Pyrimidinbasen in DNA und an intra- und extrazelluläre Proteine
bindet. Diese behandelten Leukozyten werden zum Patienten rückgeführt und
das Ergebnis ist eine Immunmodulation, von der sich herausgestellt
hat, daß sie
bei einer Reihe von Erkrankungszuständen von klinischem Nutzen
ist [Edelson RL. Photopheresis: a clinically relevant immunobiologic
response modifier. [Review] Ann NY Acad. Sci. 191; 636: 154-64].
-
Man
glaubt, daß es
eine Reihe von Erkrankungen gibt, die primär T-Zellen involvieren oder
durch T-Zellen vermittelt sind. Man glaubt, daß Erkrankungen, wie etwa Haut-T-Zelllymphom, Organ-Homotransplantat-Abstoßung nach
Transplantation, progressive systemische Sklerose (PSS), entzündliche
Darmerkrankung (IBD), rheumatoide Arthritis (RA) und juveniler Diabetes
mellitus (JODM), durch T-Zellen vermittelt sind.
-
Haut-T-Zelllymphom
(CTCL) ist eine maligne Erkrankung, die progressiv ist. Therapeutische
Optionen sind begrenzt. Edelson et al. führten einen Multicenter-Versuch
durch [Edelson R, Berger C, Gasparro F. et al. Treatment of cutaneous
T cell lymphoma by extracorporal photochemotherapy: Preliminary
results. N Engl J Med 1987; 316:297-303], der zeigte, daß 24 von
29 (83%) erythrodermer Patienten eine signifikante Verbesserung
in ihrer Erkrankung erfuhren. Diese positiven Reaktionen waren nach
einer mittleren Zeit von 22,4 Wochen nach Initiation der Therapie
zu sehen. Von klinischer Signifikanz ist, daß diese Patienten diejenigen
waren, deren Erkrankungen gegenüber
früherer
Therapie resistent waren, was man für eine schlechte prognostische
Gruppe hält.
Zusätzlich
war eine Abnahme der Menge an Beteiligung von peripherem Blut (Sezary-Zellen)
zu sehen. Versicherungsmathematische Daten hatten gezeigt, daß das mittlere Überleben
auf mehr als 60 Monate vom Einsetzen der Behandlung angestiegen
war, verglichen mit einer historischen mittleren Überlebenszeit
von weniger als 30 Monaten. In dieser ursprünglichen Gruppe von Patienten
wurden Remissionen bei acht der Patienten, die leukämisch waren,
verzögert.
Mit Photopherese verbundene nachteilige Reaktionen waren selten.
-
Autoimmunerkrankungen
sind gekennzeichnet durch eine Dysregulation des Immunsystems, die
gekennzeichnet ist durch eine spezifische zellulär oder humoral vermittelte
Zerstörung
spezifischer Organe oder Gewebe im Patienten. Beispiele für solche
Erkrankungen sind rheumatoide Arthritis und progressive systemische
Sklerose.
-
Rheumatoide
Arthritis (R.A.) ist eine entzündliche
Erkrankung, die letztendlich zu Gelenkzerstörung führt und eine generalisierte
Erkrankung ist, die viele Organsysteme betrifft. Es sind viele Pharmazeutika
in Gebrauch für
R.A., gut tolerierte Mittel mit die Erkrankung modifzierendem Potential
werden jedoch insofern benötigt,
als die Erkrankung lebenslang ist. Insbesondere ist ein Verlust
an Wirksamkeit und Fortschreiten der Erkrankung bei einer hohen
Zahl von Patienten nach dem Beginn einer Sekundärtherapie auf R.A. zu beobachten.
Viele der Sekundärmittel
sind immunsuppressiv und sind selbst der Grund für schwerwiegende Nebenwirkungen,
wie etwa Infektion. Das Bedürfnis
nach Entwicklung einer spezifischeren, nicht-toxischen immunmodulierenden
Therapie [Malawista S, Trock D, Edelson R. Treatment of rheumatoid
arthritis by extracorporeal photochemotherapy: a pilot study. Arthritis
Rheum 1991; 34:646-54] ist groß.
-
Progressive
systemische Sklerose (PSS) ist eine Bindegewebeerkrankung, die gekennzeichnet
ist durch entzündliche
und fibrotische Veränderungen
in der Haut und den Eingeweiden. Behandlung ist schwierig gewesen.
Entzündungshemmende
Arzneistoffe und Corticosteroide sind in den frühen Stadien der Erkrankung hilfreich,
scheinen aber das Fortschreiten der Krankheit nicht zu beeinflussen.
Versuche mit D-Penicillamin, Methotrexat, Cyclosporin, Calciumkanalblockern
und Prostaglandinen laufen noch, aber diese Mittel scheinen das
Fortschreiten der Erkrankung insgesamt nicht zu beeinflussen. Da
diese Erkrankung als durch T-Zellen vermittelt angesehen worden
ist, haben Rock und Kollegen PSS-Patienten mit Photopherese behandelt
[Rook AH, Freundlich B, Jegasothy BV, et al. Treatment of systemic
sclerosis with extracorporeal photochemotherapy: Results of a multicenter
trial. Arch Dermatol 1992; 128:337-46]. In diesem Versuch wurden
56 Patienten in einen randomisierten klinischen Nicht-Blindversuch
einbezogen. Eine signifikant höhere
Reaktionsrate war bei der mit Photopherese behandelten Gruppe (68%
Reaktionsrate) zu beobachten, verglichen mit der mit D-Penicillamin
behandelten (Kontroll)-Gruppe (32% Reaktionsrate).
-
Man
glaubt, daß juveniler
Diabetes mellitus (JODM) durch das Immunsystem vermittelt wird,
was zur Zerstörung
der Zellen in der Bauchspeicheldrüse führt, die verantwortlich für die Produktion
von Insulin sind. Patienten mit dieser Störung haben nicht nur eine Dysregulation
ihrer Blutzuckerspiegel, sondern die Erkrankung ist auch durch eine
Vaskulopathie gekennzeichnet, die zu spezifischer Organschädigung führt, was
zu signifikanter Morbidität
und Mortalität
führt.
-
IBD
ist entweder auf den Dickdarm begrenzt (Colitis ulcerosa) oder befällt sowohl
den Dickdarm als auch den Dünndarm.
Zusätzlich
gibt es intraintestinale Manifestationen der Erkrankung, einschießlich Pyoderma
gangränosum,
Erythema nodosum, sklerosierender Cholangitis, Spondylitis ancylopoetica,
Hepatitis, Arthritis und Uveititis. IBD involviert eine Dysfunktion
der immunregulatorischen Mechanismen, die Immunreaktionen auf Verdauungsprodukte
herunterreguliert, während
sie die Fähigkeit
aufrechterhält,
eine spezifische Immunreaktion gegen Pathogene zu entwickeln. Einwirkung
von Methoxsalen, aktiviert durch UV-Licht, moduliert die immunregulatorische
Funktion, was den mukosalen T-Zellen ermöglicht, eine niedrigere proliferative
Reaktion auf übliche
mikrobielle Antigene als periphere T-Zellen zu zeigen.
-
Andere
durch T-Zellen vermittelte Phänomene
schließen
die Abstoßung
von Geweben ein, die für
den Transplantatempfänger
fremd sind. Im Falle von Organ-Homotransplantat-Transplantationen ist es wünschenswert,
die Abstoßung
im Hinblick auf das transplantierte Organ zu verhindern, jedoch
ansonsten die Fähigkeit
des Immunsystems aufrechtzuerhalten, um den Körper zu erlauben, Infektion
zu bekämpfen,
und andere normale Körperabwehren
zu erlauben. Standardbehandlungen nach Transplantation sind begrenzt,
da die Immunsuppressionsregimes verwendet werden, um einen Zustand
generalisierter Immunsuppression zu bewirken, was zu mikrobieller
oder opportunistischer Infektion führt, der häufigsten Nebenwirkung dieser
Behandlung. Immunmodulation, die keine breiten immunsuppressiven
Eigenschaften besitzt, wäre
wünschenswerter.
Photophorese hat sich als wirksam erwiesen, und Forscher an der
Loyola University sind in der Lage gewesen, 13 von 14 Fällen kardialer
Abstoßung,
die gegen standardmäßige Immunsuppressiva
unempfindlich waren, erfolgreich mit Photophorese zu behandeln.
In einer Variation dieser Situation ist Photopherese erfolgreich
verwendet worden, um einen Patienten mit chronischer Graftversus-Host-Krankheit
zu behandeln [Rossetti et al., 1995, Transplant, 59:1, S. 149-151].
Diese Störung
ist gekennzeichnet durch einen introgen induzierten immuninkompetenten
Transplantatempfänger,
wobei immunkompetente Zellen (Knochenmark oder periphere Stammzellen)
in einen Patienten in solchen Situationen als Behandlung für verschiedene
Malignitäten
und Leukämie
infundiert werden. Hier greifen die transplantierten immunkompetenten
Zellen den Patienten (den „Transplantatempfänger") an, und die Sache
ist, die immunkompetenten Zellen zu modulieren, ohne weitere breite
Immunsuppression und die Nebenwirkungen derselben zu bewirken.
-
Photopherese
umfaßt
die extrakorporale Einwirkung von 8-Methoxypsoralen (8-MOP), das
durch Ultraviolett-A-Licht photoaktiviert worden ist, auf Leukozyten
des peripheren Blutes, gefolgt von der Reinfusion der behandelten
weißen
Blutzellen.
-
8-Methoxypsoralen-Moleküle im Blut
treten in die Kerne der weißen
Blutzellen ein und schieben sich in die doppelsträngige DNA-Helix
ein. In einem extrakorporalen Kreislauf wird langwelliges ultraviolettes
Licht mit dem UVAR®-Photopheresesystem auf
die an Leukozyten angereicherte Blutfraktion gerichtet. Der photoaktivierte
Arzneistoff, der auf die UVA-Energie
anspricht, bindet sich an die Thymidinbase in der DNA-Helix. Dies
führt zur
Quervernetzung von Thymidinbasen, was eine Entspiralisierung der
DNA während
der Transkription verhindert. Das Plasma und die veränderten
Leukozyten werden dann in den Patienten reinfundiert. Die Reinfusion
der durch Photopherese geschädigten
Leukozyten führt
zu einem verzögerten
Immunangriff gegen diese geschädigten
Leukozyten sowie andere nicht-modifizierte WBCs, die dieselben Zelloberflächenantigene
zeigen.
-
Methoxsalen
ist eine natürlich
vorkommende photoaktive Substanz, die im Samen von Ammi majus (doldentragende
Pflanze) zu finden ist. Es gehört
zu einer Klasse von Verbindungen, die als Psoralene oder Furocumarine
bekannt sind. Der chemische Name ist 9-Methoxy-7H-furo[3,2-g][l]-benzopyran-7-on.
Die Formulierung des Arzneistoffes ist eine sterile Flüssigkeit
mit einer Konzentration von 20 mcg/ml in einer 10 ml-Phiole. Die
pharmakokinetische Aktivität
von Methoxsalen ist in der Forscher-Broschüre verfügbar [Investigator's Brochure for A
Comparison Study of the Use of Extracorporeal Chemotherapy (ECP)
With and Without Alpha Interferon in Treatment of Patients with
Chronic HCV. Juni 1996]. Toxikologie-Studien von extrakorporaler
Photochemotherapie und unterschiedlichen Dosierungen von UVADEX® und
ultraviolettem Licht bei Beaglen sind in der Forscher-Brochüre angegeben.
-
UVAR-System
-
Die
Behandlung besteht aus drei Phasen, die: 1) die Sammlung einer Buffy-Coat-Fraktion
(angereichert an Leukozyten), 2) Bestrahlung der gesammelten Buffy-Coat-Fraktion
und 3) Reinfusion der behandelten weißen Blutzellen einschließen. Die
Sammelphase hat sechs Zyklen von Blutabnahme-, Zentrifugations-
und Reinfusionsschritten. Während
jeden Zyklus wird Vollblut zentrifugiert und in einer pädiatrischen
Phereseschale getrennt. Aus dieser Trennung werden Plasma (das Volumen
in jedem Zyklus wird von dem Bediener des UVAR®-Instruments
bestimmt) und 40 ml Buffy-Coat in jedem Sammelzyklus aufgehoben.
Die roten Zellen und jegliches zusätzliche Plasma werden vor Beginn
des nächsten
Sammelzyklus in den Patienten reinfundiert. Schließlich werden
insgesamt 240 ml Buffy-Coat
und 300 ml Plasma abgetrennt und für UVA-Bestrahlung aufgehoben.
-
Die
Bestrahlung des an Leukozyten angereicherten Blutes innerhalb des
Bestrahlungskreislaufes beginnt während der Sammlung von Buffy-Coat
des ersten Sammelzyklus. Das gesammelte Plasma und Buffy-Coat werden
mit 200 ml heparinisierter normaler physiologischer Kochsalzlösung und
200 mcg UVADEX® (wasserlösliches
8-Methoxypsoralen)
gemischt. Diese Mischung strömt
in einer 1,4 mm dicken Schicht durch die PHOTOCEPTOR®-Photoaktivierungskammer,
die zwischen zwei Bänken
UVA-Lampen der PHOTOSETTE® eingeschoben ist. PHOTOSETTE®-UVA-Lampen
bestrahlen beide Seiten dieser für
UVA durchsichtigen PHOTOCEPTOR®-Kammer, was eine 180-minütige Einwirkung
von Ultraviolett-A-Licht erlaubt, was eine durchschnittliche Einwirkung
pro Lymphozyt von 1-2 J/cm2 liefert. Die
endgültige
Buffy-Coat-Zubereitung enthält
geschätzt
20% bis 25% der mononukleären
Zellkomponente des peripheren Bluts insgesamt und besitzt einen
Hämatokrit
von 2,5% bis 7%. Im Anschluß an
die Photoaktivierungsperiode wird das Volumen über einen 30- bis 45-minütigen Zeitraum
in den Patienten reinfundiert.
-
Systeme,
die diese Techniken einsetzen, sind bekannt, durch die extrakorporale
Behandlung des Blutes eines Patienten durchgeführt wird. In U.S.-Patent Nr.
4,573,960 – Goss
wird einem Patienten zum Beispiel ein Arzneistoff gegeben, der Photoaktivierung
erfordert, und das Blut des Patienten wird dann abgenommen und in
seine Komponenten aufgetrennt. Die nicht-behandelten Komponenten (rote Blutzellen,
etwas Plasma, etc.) werden zum Patienten rückgeführt. Der Patient wird dann
vom Behandlungsapparat getrennt und die aufgetrennten Komponenten,
z.B. weiße
Blutzellen, werden ultraviolettem Licht ausgesetzt. Im Anschluß an die Photoaktivierung
werden die behandelten Zellen zum Patienten rückgeführt.
-
In
U.S.-Pat. Nr. 4,321,919; 4,398,906; und 4,464,166, erteilt für Edelson,
sind die externen Behandlungsmethoden für Erkrankungen diskutiert worden,
bei denen es einen pathologischen Anstieg an Lymphozyten gibt, wie
etwa Haut-T-Zelllymphom. Bei diesen Methoden wird das Blut des Patienten
in Gegenwart einer Chemikalie oder eines Antikörpers mit ultraviolettem Licht
bestrahlt. Ultraviolettes Licht bewirkt eine Bindung zwischen den
Lymphozyten und der Chemikalie oder dem Antikörper, wodurch die Stoffwechselprozesse
der Lymphozyten gehemmt werden.
-
Eine
Vielzahl menschlicher Vieren sind in der Lage, mononukleäre Zellen
zu infizieren und sich darin zu replizieren, oder infektiöse virale
Teilchen können
in den mononukleären
Zellen verbleiben. Die mononukleären
Zellen können
als entweder eine Quelle für
Virusreplikation und Verteilung des Virus oder als ein Reservoir
für infektiöse Virusteilchen
dienen, das für
das Immunsystem schwierig zu eliminieren ist. Ein Versagen bei der
Elimination dieser Quellen infektiöser Viren kann zur Etablierung
eines chronischen Zustandes führen. Viren,
die mononukleäre
Zellen infizieren, sich darin replizieren oder darin verbleiben
können,
schließen
Arboviren, Enteroviren, Paramyxoviren (RSV), Herpesviren, Cytomegalovirus
(CMV), Epstein-Barr-Virus (EBV), Hepatitis-B-Virus (HBV), Hepatitis-C-Virus
(HCV), Hepatitis-D-Virus (HDV), Hepatitis-G-Virus (HGV) und Retroviren
(wie etwa HIV) ein, sind aber nicht hierauf beschränkt.
-
Eine
Vielzahl menschlicher nicht-viraler pathogener Agentien sind in
der Lage, mononukleäre
Zellen zu infizieren und sich darin zu replizieren, oder die infektiösen nicht-viralen
pathogenen Agentien können
in den mononukleären
Zellen verbleiben. Die mononukleären
Zellen können
als entweder eine Quelle für
Replikation und Verteilung der nicht-viralen pathogenen Agentien
oder als ein Reservoir infektiöser
nicht-viraler pathogener Agentien dienen, das für das Immunsystem schwierig
zu eliminieren ist. Ein Versagen, diese Quellen infektiöser nicht-viraler
pathogener Agentien zu eliminieren, kann zur Etablierung eines chronischen
Zustandes führen.
Nicht-virale pathogene Agentien, die mononukleäre Zellen infizieren, sich
darin replizieren oder darin verbleiben können, schließen Bakterien,
wie etwa Arbobakterien, Mycoplasma-Spezies und Mycobacteria-Spezies,
und Parasiten, wie etwa Plasmodium-Spezies und andere Arboparasiten,
ein.
-
Extrakorporale
Photopherese (ECP) ist mit Erfolg verwendet worden, um HIV-Infektion
zu behandeln (U.S.-Patent Nr. 4,960,408), und es ist gezeigt worden,
daß Psoralenverbindungen
mit langwelligem ultravioletten Licht bestimmte Viren, wie etwa
HIV (Quinnan, G.V. et al., 1986, Transfusion, 26, S. 481; Bisaccia,
A. et al., 1990, Am. Intern. Med., 113, S. 270; Bisaccia, A. et
al., 1991, Ann. NY Acad. Sci.; 636, S. 321) und Influenza-Virus
und Herpessimplex-Virus (Redfield, D.C. et al., 1981; Infect. and
Immun., 32, S. 1216), in vitro zu inaktivieren. Bisaccia hat ECP
in einem Pilotversuch als Therapie für Patienten mit dem AIDS-Komplex
untersucht. Die Überlegung
war, daß eine
Kombination von Psoralen mit UVA-Aktivierung HIV in vitro schädigen könnte und
daß Reinfusion
des geschädigten
Virus eine Immunreaktion initiieren könnte. Die Autoren stellten fest,
daß ECP
einen Anstieg der HIV-Ab-Produktion, einen Anstieg der CD8(+)-Lymphozyten,
eine Abnahme im p24-Antigentiter
und die Unfähigkeit,
HIV in 3 Patienten zu kultivieren, bewirkte. Elf der 20 Patienten
zeigten Verbesserung ihrer Haut-Testantigen-Reaktivitäten.
-
Zusätzlich wurde
ein verringertes Auftreten von Infektionsepisoden bei Patienten
berichtet, die Photopheresebehandlung für Immunsuppression im Anschluß an Transplantatchirurgie
erhielten (Meiser, B.M. et al., 1994, Transplantation, 57, S. 563).
Die für
die Transplantatchirurgiepatienten beobachteten Ergebnisse korrelierten
jedoch nicht mit der Photopheresebehandlung, da Infektionsepisoden
allgemein aufgezeichnet wurden, einschließlich Patienten, die eine Vielzahl
von Behandlungen erhielten, um die Abstoßung des transplantierten Organs
zu verhindern.
-
US-A-5368841
offenbart ein Verfahren zur Behandlung einer proliferativen entzündlichen
Gelenkerkrankung in einem Patienten, welches a) Verabreichung einer
photoaktivierbaren zytotoxischen Verbindung oder eines Vorläufers derselben
an besagten Patienten, so daß besagte
Verbindung oder besagter Vorläufer in
Synovialgewebe von besagtem Patienten akkumuliert, und anschließend b)
Verabreichen von Licht einer photoaktivierenden Wellenlänge zu besagtem
Synovialgewebe, um besagte Verbindung oder besagten Vorläufer zu
aktivieren, um die Zerstörung
besagten Gewebes zu bewirken, umfaßt.
-
WO-A-9324134
offenbart ein Verfahren zur Behandlung eines pathologischen Zustandes,
der gekennzeichnet ist durch Hyperproliferation von Haut- oder Epithelzellen,
welches die Einwirkung einer die Hyperproliferation hemmenden Menge
eines Oligomers auf Haut- oder Epithelzellen umfaßt, das
ausgewählt
ist aus (a) einem Antisense-Oligomer mit einer Sequenz, komplementär zu einer
RNA-Sequenz, transkribiert von einem Zielgen, das in den Zellen
vorhanden ist; (b) einem Drittstrang-Oligomer mit einer Sequenz,
komplementär
zu einer ausgewählten
doppelsträngigen
Nukleinsäuresequenz
eines Zielgens, das in den Zellen vorhanden ist; und (c) einem Triplex-Oligomerenpaar,
das komplementär
ist zu einer einzelsträngigen
Nukleinsäuresequenz eines
Zielgens oder ihrem Transkriptionsprodukt, wobei besagtes Zielgen
ausgewählt
aus den definierten, wodurch Hyperproliferation der Zellen verringert
wird. Das Oligomer kann eine Nukleinsäure-modifizierende Gruppe umfassen,
die photoreaktiv ist.
-
US-A-5383847
offenbart ein Verfahren zur nicht-spezifischen Verstärkung der
Immunsystemreaktion eines immundefizitären Säugers auf ein Antigen, wobei
das Verfahren die Schritte umfaßt:
a) Bestimmen, ob die Zahl an Helfer/Inducer-T-Zellen des Säugers wenigstens
150 pro Kubikmilliliter Blut beträgt, und, falls dies der Fall
ist, Durchführen
der folgenden Schritte (b)-(d); b) Abnehmen von Leukozyten enthaltendem
Material vom Säuger;
c) Behandeln der abgenommenen Leukozyten in einer Weise, um die
Zellen zu verändern;
und d) Rückführen der
behandelten Leukozyten zum Säuger.
-
Zusammenfassung
der Erfindung
-
Gemäß der vorliegenden
Erfindung wird die Verwendung einer photoaktivierbaden Verbindung
bereitgestellt, die Psoralen oder ein Psoralen-Derivat umfaßt, zur
Herstellung eines Arzneimittels für eine extrakorporale Behandlung,
wie definiert in den beigefügten
Ansprüchen.
-
Detaillierte
Beschreibung der Erfindung
-
Die
Behandlung, die einen Teil der Erfindung bildet, ist auf die Verwendung
von Photopherese gerichtet, um Patienten mit einer entzündlichen
Darmstörung,
einschließlich
IBD, Crohn-Krankheit, Colitis ulcerosa, aber nicht hierauf beschränkt, oder
Patienten mit einer entzündlichen
Störung
der Harnblase, einschließlich Cystitis,
wie etwa interstitieller Cystitis, aber nicht hierauf beschränkt, zu
behandeln.
-
Man
glaubt, daß extrakorporale
Photochemotherapie unter Verwendung von Methoxsalen (Photopherese)
eine Immunisierung gegen abnorme (im Falle von CTCL krebsartige)
T-Zellen bewirkt.
Während
der Photopherese tritt Methoxsalen in die Kerne der weißen Blutzellen
ein und schiebt sich in die doppelsträngige DNA-Helix ein. In einem
extrakorporalen Kreislauf wird langwelliges ultraviolettes Licht
auf das an Leukozyten angereicherte Blutvolumen gerichtet. Das Methoxsalen,
das auf die UVA-Energie anspricht, bindet sich an die Thymidinbase
in der DNA-Helix. Dies führt
zur Quervernetzung von Thymidinbasen, was die Entspiralisierung der
DNA während
der Transkription verhindert. Ultraviolett-A-Licht (UVA) schädigt abnorme
T-Zellen, was sie immunogener macht. Nachdem Zellen photoaktiviert
worden sind, bewirkt die Reinfusion dieser veränderten T-Zellen eine immunologische Reaktion,
die T-Zellen anzielt, die dieselben Oberflächenantigene tragen [Edelson
RL. Photopheresis: a clinically relevant immunobiologic response
modifier. [Review] Ann NY Acad Sci. 191; 636:154-64]. Dies führt zur
Erzeugung einer hochspezifischen Immunreaktion gegen die abnormen Zellen
(entweder einen Krebsklon oder vielleicht T-Zellen, die virale Antigene
auf ihrer Oberfläche
exprimieren). Es wird geschätzt,
daß ungefähr 25-50%
des 5-Compartments mononukleärer
Zellen des peripheren Bluts insgesamt pro Photopheresesitzung (an
zwei aufeinanderfolgenden Tage) behandelt werden.
-
Eine
Arbeit von Vowels [Vowels BR, Cassin M, Boufal MH, et al. Extracorporeal
photochemotherapy induces the production of tumor necrosis factor-alpha
by monocytes: Implications for the treatment of cutaneous T cell
lymphoma and systemic sclerosis. J Invest Dermatol 1992; 98:686-92]
zeigte, daß Monozyten,
die in einem extrakorporalen Kreislauf von Plasma, das 8-Methoxypsoralen
enthielt, und durch Einwirkung von Ultraviolett-A-Licht (Photopherese)
behandelt worden waren, Tumor-Nekrose-Faktor-alpha, IL-1, IL-6 und
möglicherweise
IL-8 freisetzten. Man glaubt, daß Photopherese die Aktivität von Monozyten/Makrophagen
des peripheren Blutes moduliert.
-
Gemäß der vorliegenden
Erfindung wird zunächst
eine photoaktivierbare oder photosensitive Verbindung dem Blut eines
Patienten zugeführt,
der eine entzündliche
Darmstörung
oder eine entzündliche
Störung der
Harnblase aufweist. Die photoaktivierbare oder photosensitive Verbindung
wird in vitro einem Teil des Blutes des Patienten (dem an Leukozyten
angereicherten Buffy-Coat) verabreicht, der vom Patienten durch
Anwendung herkömmlicher
Blutabnahmetechniken abgenommen worden ist.
-
Gemäß der vorliegenden
Erfindung sollte die photoaktivierbare oder photosensitive Verbindung
in der Lage sein, bei Aktivierung durch Einwirkung elektromagnetischer
Strahlung eines vorgeschriebenen Spektrums, z.B. ultravioletten
Lichtes, an Nukleinsäuren
zu binden.
-
Als
nächstes
wird der Teil des Blutes des Patienten, dem die photoaktive Verbindung
verabreicht worden ist, behandelt, indem der Teil des Blutes einer
Photopherese unter Verwendung von ultraviolettem Licht unterworfen
wird. Der Photophereseschritt wird in vitro unter Verwendung einer
extrakorporalen Photophereseapparatur durchgeführt. Eine gegenwärtig bevorzugte
extrakorporale Photophereseapparatur zur Verwendung in dem Verfahren
gemäß der Erfindung
wird gegenwärtig
von Therakos, Inc., unter dem Namen UVAR® hergestellt.
Eine Beschreibung einer solchen Apparatur ist zu finden in U.S.-Patent Nr.
4,683,889. Die Einwirkung von ultraviolettem Licht auf Blut in einer
Photophereseapparatur liegt innerhalb der Fähigkeiten der Durchschnittsfachleute.
-
Bei
der Durchführung
des Photophereseschrittes in vitro wird wenigstens eine Fraktion
des behandelten Blutes zum Patienten rückgeführt. Die hierin beschriebene
Behandlungsmethode wird in einem Intervall von einmal pro Woche
bis einmal alle vier Wochen wiederholt. Photoaktive Verbindungen
zur Verwendung gemäß der vorliegenden
Erfindung sind Verbindungen, die als Psoralene (oder Furocumarine)
bekannt sind, sowie Psoralen-Derivate, wie etwa diejenigen, die
in U.S.-Patent Nr. 4,321,919 und U.S.-Patent Nr. 5,399,719 beschrieben
sind. Alternativ kann das Blut des Patienten auf einer Standard-Apheresevorrichtung
getrennt und auf einer separaten Vorrichtung photoaktiviert werden.
-
Die
bevorzugten photoaktivierbaren oder photosensitiven Verbindungen
zur Verwendung gemäß der vorliegenden
Erfindung schließen
die folgenden ein: Psoralen und Psoralen-Derivate; 8-Methoxpsoralen; 4,5',8-Trimethylpsoralen;
5-Methoxypsoralen; 4-Methylpsoralen;
4,4-Dimethylpsoralen; 4,5'-Dimethylpsoralen; 4'-Aminomethyl-4,5',8-trimethylpsoralen;
4'-Hydroxymethyl-4,5',8-trimethylpsoralen;
4',8-Methoxypsoralen und
ein 4'-(omega-Amino-2-oxa)-alkyl-4,5',8-trimethylpsoralen,
einschließlich,
aber nicht beschränkt
auf 4'-(4-Amino-2-oxa)-butyl-4,5',8-trimethylpsoralen,
sind aber nicht hierauf beschränkt.
Die bevorzugteste photosensitive Verbindung zur Verwendung gemäß dieser
Erfindung ist 8-Methoxypsoralen.
-
Die
photosensitive Verbindung wird dem Blut des Patienten im Anschluß an seine
Abnahme vom Patienten und vor oder gleichzeitig mit der Einwirkung
von ultraviolettem Licht verabreicht. Die photosensitive Verbindung
kann Vollblut oder einer Fraktion desselben verabreicht werden,
vorausgesetzt, daß die
Zielblutzellen oder -blutkomponenten die photosensitive Verbindung
erhalten.
-
Die
Photopheresebehandlung, die einen Teil der vorliegenden Erfindung
bildet, wird unter Verwendung von langwelligem ultravioletten Licht
(UVA) mit einer Wellenlänge
im Bereich von 320 bis 400 nm durchgeführt. Die Einwirkung von ultraviolettem
Licht während
der Photopheresebehandlung hat vorzugsweise eine Dauer mit ausreichender
Länge,
um etwa 1-2 J/cm2 zum Blut zuzuführen.
-
Zunächst wird
eine photosensitive Verbindung, wie hierin zuvor beschrieben, zu
wenigstens einem Teil des Blutes des Spenders nach Abnahme vom Patienten
verabreicht (d.h. es wird in vitro verabreicht). Ein Teil des Blutes
des Spenders wird zunächst
unter Verwendung bekannter Methoden verarbeitet, um im wesentlichen
die Erythrozyten zu entfernen, und die photoaktive Verbindung wird
dann zur resultierenden, an Leukozyten angereicherten Fraktion verabreicht.
-
In
jedem Fall wird der Teil des Blutes (die an Leukozyten angereicherte
Fraktion desselben), zu der die photosensitive Verbindung verabreicht
worden ist, einer Photoaktivierungsbehandlung unter Verwendung von ultraviolettem
Licht, vorzugsweise UVA, in der zuvor beschriebenen Art und Weise
unterzogen. Die behandelte, an Leukozyten angereicherte Fraktion
wird dann dem Spender zurück
verabreicht.
-
Die
gegenwärtige
Behandlung für
entzündliche
Darmstörungen
schließt
Chemotherapeutika, wie etwa Aminosalicylate, Corticosteroide und
Immunsuppressiva, ein. Signifikante Nebenwirkungen von diesen chemotherapeutischen
Behandlungen treten auf. Viele Patienten entwickeln Nebenwirkungen
von Aminosalicylaten, bevor sie eine therapeutische Dosis erreichen.
Die Nebenwirkungen Übelkeit,
Indisposition, Kopfschmerzen und Myalgie führen oft zur Ablehnung durch
den Patienten. Die Nebenwirkungen des Langzeitgebrauches von Corticosteroiden
(Cushing-Aussehen, Bluthochdruck, Kataraktbildung, Osteoporose und
aseptische Nekrose) sind gut dokumentiert. Zusätzlich ist, obgleich Corticosteroide
wirksam bei der Behandlung des plötzlichen Aufflackerns der Erkrankung
sein können,
die Fähigkeit
dieser Arzneistoffe, einen Rückfall
zu verhindern, nie bewiesen worden. Ein erhöhtes Risiko der Entwicklung
von Krebs, Neutropenie und Knochenmarksuppression ist in der Organtransplantat-Einpfängerpopulation
gut dokumentiert.
-
Eine
zusammenfassende Beschreibung bestimmter entzündlicher Darmstörungen,
die mit dem Verfahren der vorliegenden Erfindung behandelt werden,
schließt,
ohne Beschränkung
hierauf, ein:
-
1. Colitis
ulcerosa
-
Colitis
ulcerosa ist eine Schleimhautstörung,
die den Dickdarm befällt
und mit signifikanter Morbidität und
Mortalität
assoziiert ist. Es gibt assoziierte extraintestinale Manifestationen
dieser Erkrankung, die Arthritis, Spondylitis ancylopoetica, Hepatitis,
Uveititis, Pyoderma gangränosum,
Erythema nodosum und sklerosierende Cholangitis einschließen. Krebs
kann in Bereichen chronischer Entzündung auftreten. Spezifische
Syndrome von Colitis ulcerosa schließen Diarrhoe, Darmbluten, Gewichtsverlust
und Bauchschmerzen und -krämpfe
ein. Diese Erkrankung kann Individuen jeden Alters befallen. Kinder
mit dieser Erkrankung wachsen und entwickeln sich nicht normal.
-
2. Crohn-Krankheit
-
Crohn-Krankheit
ist gekennzeichnet durch focale, transmurale und asymmetrische Entzündung, die ein
oder mehrere Segmente des Ernährungskanals
involviert, die sich irgendwo vom Mund bis zum Anus erstrecken.
Die am häufigsten
involvierten Bereiche schließen
den distalen Krummdarm und rechten Dickdarm ein. Ausschließlich Dickdarmbefall
tritt bei etwa 20% auf und auf den Dünndarm beschränkte Erkrankung
tritt bei 15-20% bei Patienten auf, die an Crohn-Krankheit leiden.
Die Ulcerationen, die mit Crohn-Krankheit assoziiert sind, erstrecken
sich linear, wobei sie oft Taschen normaler Schleimhaut isolieren,
was dieser Krankheit das charakteristische Aussehen von Kopfsteinpflaster
gibt.
-
Eine
zusammenfassende Beschreibung bestimmter entzündlicher Störungen der Harnblase, die mit dem
Verfahren der vorliegenden Erfindung behandelt werden, schließt, aber
ohne Beschränkung
hierauf, ein:
-
1. Interstitielle Cystitis
(IC)
-
Interstitielle
Cystitis (IC) ist eine chronische schwere Blasenstörung, die
insofern ähnlich
zu IBD ist, als sie eine Autoimmunerkrankung ist, die sich selbst
als einen Angriff auf die Blasenwand, statt der Darmwand, manifestiert.
Wie IBD kann IC histologisch als eine unifocale oder multifocale
entzündliche
Infiltration der Blasenwand mit Schleimhautulceration und Narbenbildung
identifiziert werden. Sie führt
zu Kontraktion des Glattmuskels, verringerter Harnblasenkapazität, Häufigkeitssymptomen,
Hämaturie,
Harndrang, nächtlichem
Wasserlassen, schmerzhaftem Urinieren und suprapubischem Beckenschmerz.
Behandlungen, wie etwa Amitriptylin, Hydroxyzin, Dimethylsulfoxid,
Chlorpactin und Heparin, können
Symptome verbessern, ändern
aber nicht den Langzeitverlauf der Erkrankung.
-
Die
Verwendung der vorliegenden Erfindung für entzündliche Darmstörungen,
einschließlich,
aber nicht beschränkt
auf IBD, Crohn-Krankheit, und für
entzündliche
Störungen
der Harnblase, einschließlich,
aber nicht beschränkt
auf Cystitis, wie etwa IC, ist eine Eliminierung der Symptome der
Erkrankung, was sich als eine Verringerung im Aktivitätsindex
für die
Erkrankung und/oder einer signifikanten Verringerung der Steroiddosis
(insbesondere für
diejenigen, die steroidabhängig
sind) und/oder der Vermeidung eines chirurgischen Eingriffes (Entfernung
des befallenen Gewebes) und zunehmend symptomfreien Intervallen
bei diesen Patienten widerspiegelt.
-
Die
folgenden Beispiele werden vorgelegt, um die vorliegende Erfindung
zu veranschaulichen, und sollen nicht als eine Beschränkung derselben
angesehen werden.
-
BEISPIEL 1
-
EXTRAKORPORALE PHOTOCHEMOTHERAPIE
BEI DER BEHANDLUNG VON PATIENTEN MIT COLITIS ULCEROSA
-
I. Beschreibung der Patientenpopulation
-
Patienten,
die ein akutes Aufflackern ihrer Colitis ulcerosa durchlaufen, waren
die Gegenstände
dieser klinischen Untersuchung. Um zur Einbeziehung in dieses Protokoll
eingeschlossen werden zu können,
mußten die
folgenden Einschluß-/Ausschluß-Kriterien
erfüllt
werden:
- – Patienten
müssen
40 kg wiegen
- – Frauen
mit Gebärpotential
müssen
einen negativen Urin-Schwangerschaftstests innerhalb von 24 Stunden
vor dem Beginn der Studienbehandlung abliefern. Wirksame Geburtenkontrolle
muß für einen
Monat vor der Studienbehandlung bis zum Ende der Behandlungsphase
des Protokolls praktiziert werden. Frauen dürfen nicht stillen.
- – Laborwerte
vor der Studie:
- • WBC
von mehr als 3,0 cmm
- • Hämoglobin
von mehr als 6,5 mg/dl
- • Plättchenzahl >75.000/UL
- • Prothrombinzeit
nicht mehr als 2 Sekunden über
den normalen Bereich hinaus
- – In
der Lage, informierte Zustimmung zu geben
- – Angemessener
Venenzugang
- – In
der Lage und willens, das Studienprotokoll und die Medikationsschemata
zu befolgen
- – Die
Diagnose Colitis ulcerosa muß durch
die Geschichte und physikalische Untersuchung, endoskopische und
histologische Bewertung bestätigt
werden. Das Ausmaß der
Erkrankung muß wenigstens
10 cm vom Analring liegen.
- – Um
sich für
die Studie zu qualifizieren:
- • Der
Patient muß einen
akuten, mäßigen bis
schweren Rückfall
seiner Colitis ulcerosa erleiden und wird wenigstens drei der sieben
aufgelisteten Kriterien erfüllen:
- – Diarrhoe >6/Tag
- – Blut
im Stuhl
- – Fieber >37,7
- – Herzrate >90/min
- – Anämie weniger
als 75% von normal
- – ESR >30
- – Steroidabhängig – oder –
- • Kandidat
für chirurgischen
Eingriff
-
II. Beschreibung der Behandlungshäufigkeit
und Wirksamkeitsparameter
-
Photopheresebehandlungen
wurden an zwei aufeinanderfolgenden Tagen für vier Wochen (8 Photopheresebehandlungen)
durchgeführt
und wurden dann an zwei aufeinanderfolgenden Tagen jede zweite Woche
für die
nächsten
acht Wochen (8 zusätzliche
Behandlungen) für
insgesamt 16 Photophereseverfahren über 12 Wochen durchgeführt (definiert
als Behandlungszeitraum I). Das Ziel von Behandlungszeitraum I war, die
primären
Wirksamkeitsparameter zu bestimmen (Krankheitsaktivitätsindex
[DAI], Bestimmung der Notwendigkeit eines chirurgischen Eingriffs,
Bestimmung der Fähigkeit
von Patienten, sich von Steroiden oder anderen immunsuppressiven
Medikationen zu entwöhnen,
die verwendet wurden, um die Symptome von Colitis ulcerosa zu kontrollieren,
und Bestimmung der Reaktion auf Behandlung auf einem endoskopischen
histologischen Niveau). Für
den Zweck dieses Protokolls wurde eine erfolgreiche Reaktion auf
Behandlung definiert als:
Eine 50%-ige Abnahme des Krankheitsaktivitätsindex
(DAI), das Vermeiden eines chirurgischen Eingriffes oder die Verringerung/Eliminierung
von Steroiden und Verbesserung in der Endoskopieeinstufung und Histologie
werden alle als klinisch signifikant angesehen.
-
Nachdem
Behandlungsphase I abgeschlossen war, wurde der Patient dann für neun Monate
nach Absetzen der Behandlung verfolgt. Aufflackern (wie belegt durch
Zunahme der Symptomatologie von Colitits ulcerosa [Diarrhoe, Bluten
und Schmerzen]) während
dieses Verfolgungszeitraums wurden mit Photopherese nach Gutdünken des
Forschers behandelt. Das Ziel dieses Nachfolgeprotokolls war: (1)
krankheitsfreie Intervalle zu berechnen, (2) zu bestimmen, ob ein
Aufflackern der Krankheit durch Photopherese kontrolliert werden kann,
und (3) Daten über
das Entwöhnen
von der Photopheresetherapie zu liefern.
-
III. Beschreibung der
Wirksamkeitsbewertungen:
-
Während der
Behandlungs- und Nachfolgezeiträume
hatte der Patient die folgenden Wirksamkeitsbewertungen:
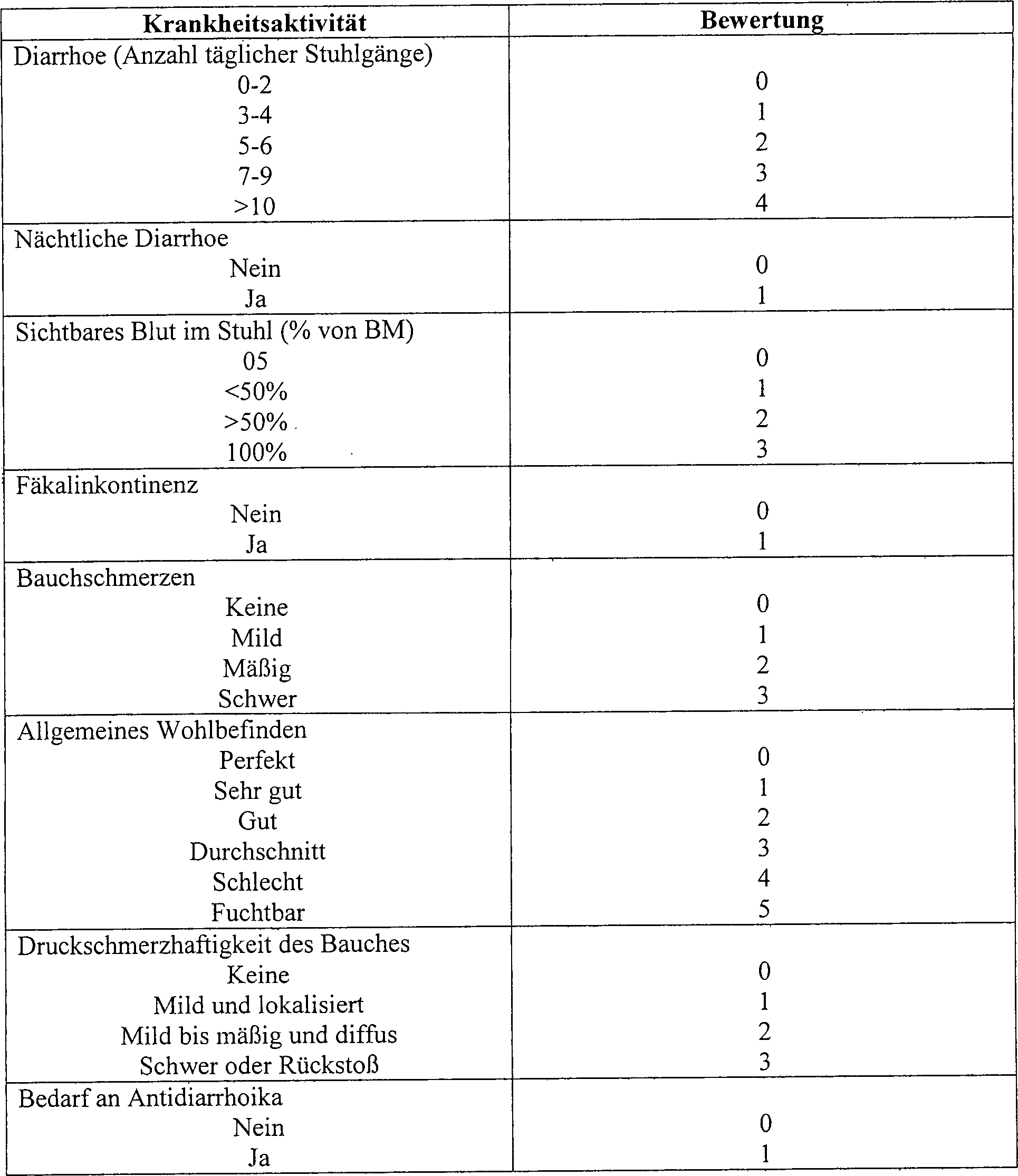
- A. Krankheitsaktivitätsindex: Dies ist eine modifizierte
Truelove/Witts-Skala, wie beschrieben von Lichtiger et al. (Tabelle
1). Diese Skala bewertet die Zahl an blutigen Darmbewegungen, Auftreten
von nächtlicher Diarrhoe,
Inkontinenz, Bauchschmerzen, allgemeines Wohlbefinden und Druckschmerzhaftigkeit
des Bauches. Die minimale Bewertung ist 0. Die maximale Bewertung
ist 21. Bewertungen von 12 oder höher werden als in der schwerwiegenden
Kategorie liegend angesehen. Signifikante Verbesserung zeigt eine
Abnahme des DAI um 50%. Bewertungen von weniger als 4 zeigen klinische
Remission. Tabelle
1: Krankheitsaktivitätsindex
- B. Endoskopische Befunde wurden aufgrund einer modifizierten
Skala, festgelegt durch Blackstone et al., bewertet, die die Schwere
der Granularität,
Gefäßmuster,
Brüchigkeit,
Ulceration und Mucopus bewertet. Die Analyse der endoskopischen
Befunde wurde separat von den Symptombewertungen (Tabelle 2) analysiert.
Eingeschlossen in der endoskopischen Bewertung waren die Bestimmung
der Länge
der endoskopischen Erkrankung und ihre entsprechende Schleimhautschwere. Tabelle
2: Endoskopische Schleimhaut-Schwerebewertung
- C. Histologie: wurden von einem Pathologen bewertet. Die Histologieeinstufungsbewertung
ist ein System, das sowohl Aktivität als auch Schwere der Erkrankung
einstuft. Histologieindex (oder -bewertung) wurde ausgedrückt durch
Addieren der Werte für
alle fünf
Kriterien, und dieser Gesamtwert wurde ausgedrückt als der Gesamtwert aus
einer maximalen Gesamtwertung von fünfzehn.
-
1. AKTIVITÄTSINDEX
-
Kriterium #1: NEUTROPHILE
LEUKOZYTEN IN INTAKTER LAMINA PROPRIA
-
Methode:
Die Anzahl von Neutrophilen in einem Feld mit hoher Verstärkung (x40)
des aktivsten entzündeten
Bereiches der intakten Schleimhaut wurde gezählt. Ulcusbruchstücke und
Granulationsgewebe wurden ausgeschlossen.
- 0 = keine Neutrophilen
- 1 = 1-10/hpf
- 2 = 11-20/hpf
- 3 = >21/hpf
-
Kriterium #2 AKUTE CRYPTITIS
-
Methode:
Bewertung der Neutrophilen-Infiltration von Krypten, einschließlich Kryptenabzessen
und Krpytenzerstörung
durch die akute Entzündung.
- 0 = keine Cryptitis
- 1 = Krypteninfiltration durch Neutrophile; keine Kryptenabzesse;
keine aktive Kryptenzerstörung
- 2 = Kryptenabzesse +; keine aktive Kryptenzerstörung
- 3 = aktive Kryptenzerstörung
-
Kriterium #3 EROSION/ULCERATION
-
- 0 = keine Erosion oder Ulceration
- 1 = nur fokale teilweise dicke Schleimhauterosion
- 2 = Vorhandensein von akutem entzündeten nekrotischen Gewebe
frei von Schleimhaut (= oberflächlicher
Ulcus)
- 3 = Vorhandensein von akutem entzündeten Granulationsgewebe (=
tiefer Ulcus)
-
2. ERKRANKUNGSCHRONIZITÄTSINDEX
-
Kriterium #4 KRYPTENARCHITEKTUR
-
- 0 = normal
- 1 = milde Verzerrung
- 2 = mäßige Verzerrung
mit klarer Verzweigung
- 3 = schwere Verzerrung
-
Kriterium #5 CHRONISCHE
ENTZÜNDUNG
IN LAMINA PROPRIA
-
Methode:
Bestimmung von Lymphozyten-, Plasmazellen- und Eosinophilenzahlen
(subjektiv, keine Zählung)
- 0 = normal
- 1 = milder Anstieg
- 2 = mäßiger Anstieg
- 3 = starker Anstieg
-
Nebenwirkungen
wurden wie folgt bewertet:
- – Die Häufigkeit und Schwere von Nebenwirkungen
klassifiziert durch ihre Beziehung zur Vorrichtung, zum Arzneistoff
und zur Erkrankung
- – Die
Häufigkeit
abnormer Laborparameter und neuer Symptomatologie bei jedem Behandlungsbesuch.
-
IV. Probenschema der Bestimmungen
-
A. Basislinienbestimmungen
(innerhalb von 48 Stunden nach der ersten Photopheresebehandlung)
-
- – CBC
- – Chemie
- – Sedimentationsrate
- – Krankheitsaktivitätsindex
(DAI)
- – Auflistung
gleichzeitiger Medikation
- – Endoskopie
mit histologischer Bewertung
- – Fragebogen
zur Lebensqualität
-
B. Vor jeder zweitägigen Photopheresesitzung
-
- – CBC
- – Auflistung
gleichzeitiger Medikation
-
C. Alle zwei Wochen während der
Behandlungsphase
-
- – Chemiepanel
- – Sedimentationsrate
- – Krankheitsaktivitätsindex
(DAI)
-
D. Pre-tx #5
-
- – Fragebogen
zur Lebensqualität
-
E. Monatlich
-
- – Urin-Schwangerschaftstest
(falls zutreffend)
-
F. In den Wochen 6 und
12 der Photopheresebehandlung
-
- – Endoskopische
und histologische Bewertung
- – Fragebogen
zur Lebensqualität
- – CD4/CD8
(nur Woche #12)
-
G. Bewertung nach der
Behandlung
-
Einen Monat
im Anschluß an
die letzte Behandlung in Periode I
-
- – CBC
- – Sedimentationsrate
- – Chemie
- – Krankheitsaktivitätsindex
(DAI)
- – CD4/CD8
- – Fragebogen
zur Lebensqualität
- – Auflistung
gleichzeitiger Medikation
-
Monate 3, 6 und 9
-
- – CBC
- – Sedimentationsrate
- – Chemie
- – Krankheitsaktivitätsindex
(DAI)
- – Fragebogen
zur Lebensqualität
- – Auflistung
gleichzeitiger Medikation
-
Monate 2, 4, 5, 7 und
8
-
- – Krankheitsaktivitätsindex
(DAI)
-
V. Ergebnisse
-
-
-
Patient CU 1/1
-
Zusammenfassung:
Eine 26 Jahre alte Frau mit endoskopisch und histologisch bestätigter Diagnose von
Colitis ulcerosa
-
Basislinienbestimmung:
Eintritt in das Protokoll mit Diarrhoe von mehr als 7- bis 9-mal
pro Tag, Fäkalinkontinenz,
grobes Blut im Stuhl und Fieber von mehr als 37,7. Kolonoskopie
zeigte Schleimhautveränderungen
von 20 bis 0 cm. Die Befunde schlossen ein erythematöses Erscheinungsbild,
oberflächliche
Erosionen, klinisch manifeste Hämorrhagie.
Die Histologieaktivitätsbewertung
betrug 6, die CU-Chronizitätsbewertung
betrug 3 und die Endoskopiebewertung betrug 2. Der Krankheitsaktivitätsindex
der Patienten betrug 8 bis 20 und der Fragebogen zur Lebensqualität der Patienten
ergab einen Gesamtwert von 151 von möglichen 224 Punkten. Die Patientin
berichtete im Patiententagebuch, sich „leidlich" zu fühlen und „mäßigen" Schmerz zu erleiden.
-
Zwei-Wochen-Evaluation:
Der Krankheitsaktivitätsindex
der Patientin fiel auf 5 von 20, wobei die Hauptbereiche der Verbesserung
als eine verringerte Zahl von Diarrhoe-Episoden auf 3- bis 4-mal
pro Tag und keine Fäkalinkontinenz
notiert wurden. Die Lebensqualität
der Patienten stieg auf 169 von möglichen 224 Punkten. Die Patientin
berichtete im Patiententagebuch, sich „gut" zu fühlen mit nur „mildem" Schmerz, die Patientin
berichtete immer noch über
Blut im Stuhl.
-
Sechs-Wochen-Evaluation:
Der Krankheitsaktivitätsindex
der Patientin fiel auf 2 von 20, wobei der Hauptbereich der Verbesserung
als eine verringerte Anzahl von Diarrhoe-Episoden auf 0- bis 2-mal
pro Tag und keine Fäkalinkontinenz
notiert wurde. Die Lebensqualität
der Patientin stieg auf 208 von möglichen 224 Punkten. Die Patientin
berichtete im Patiententagebuch, sich „sehr gut" zu fühlen, mit „keinem" Schmerz und berichtete über viel
mehr Tage ohne Blut im Stuhl. Sigmoidoskopie zeigte Schleimhautveränderungen
im Rektum, mit sowohl erythematösen
als auch granulären
Veränderungen.
Der visualisierte Dickdarm (bis zu 30 cm) war grob normal. Die CU-Histologiebewertung
sank von 6 auf 1, die CU-Chronizitätsbewertung sank von 3 auf 2
und die Endoskopiebewertung verringerte sich von 2 auf 1. Patient
#3 RJK
-
Patient UC 1/3
-
Zusammenfassung:
Ein 42 Jahre alter Mann mit einer mehr als 5 jährigen Geschichte Steroidabhängigkeit,
um Symptome von Colitis ulcerosa zu kontrollieren.
-
Basislinien-Evaluation:
Trat in das Protokoll mit blutigen Stuhlgängen ein, wobei Kolonoskopie Schleimhautveränderungen
von 0 cm bis 40 cm zeigte. Endoskopiebefunde schlossen Ödem, ein
erythematöses
und brüchiges
Aussehen, aphtoide Erosionen, (ein Erythemwall, ein gelb-grauer
zentraler Krater, Nicht-Vorhandensein eines erhabenen Randes), ein
verschwommenes/abgestumpftes Gefäßmuster.
DAI betrug 3 und der Patient erhielt Prednison 20 mg an jedem zweiten
Tag. Basislinien/Lebensqualität
betrug 188 von möglichen
224 Punkten.
-
Zwei-Wochen-Evaluation:
DAI immer noch 3, aber der Patient hatte auf Prednison 10 mg jeden
zweiten Tag herunter abgesetzt, ohne Anstieg der Symptome. Lebensqualität ist von
188 auf 212 gestiegen.
-
BEISPIEL 2
-
EXTRAKORPORALE PHOTOCHEMOTHERAPIE
BEI DER BEHANDLUNG VON PATIENTEN MIT CROHN-KRANKHEIT
-
I. Beschreibung der Patientenpopulation
-
Patienten,
die ein akutes Aufflackern ihrer Crohn-Krankheit zeigen, sind die
Gegenstände
dieser klinischen Untersuchung. Um zur Einbeziehung in dieses Protokoll
eingeschlossen zu werden, wurden die folgenden Einschluß-/Ausschluß-Kriterien
erfüllt:
-
A. Einschlußkriterien
-
- – Alter
zwischen 18 und 65
- – Diagnose
Crohn-Krankheit nach Malchow-Kriterien und Crohn-Aktivitätsindex
(CDAI)
- – Radiologische
und/oder endoskopische und/oder sonographische Lokalisierung innerhalb
der letzten 12 Monate vor dem Beginn der Studie dokumentiert
- – Steroidabhängiger Krankheitsverlauf
mit einer dokumentierten Behandlung mit wenigstens 10 mg Prednison
pro Tag für
wenigstens die letzten drei Monate, die benötigt wurde, um eine Remission
zu erreichen (Remission ist definiert als ein CDAI <200 für zwei aufeinanderfolgende
Wochen). Die Steroidabhängigkeit muß durch
eine Geschichte mit wenigstens einem Rückfall (CDAI >200) in einem Versuch,
die Steroiddosis auf <10
mg zu verringern, bestätigt
sein.
- – Schriftliche
oder mündliche
Zustimmung in Gegenwart eines Zeugen, nachdem der Patient gründlich von dem
behandelnden Arzt informiert worden ist.
- – Vor
Beginn der Behandlung müssen
alle Frauen im gebärfähigen Alter
einen dokumentierten negativen Serum-beta-HCG-Schwangerschaftstest
innerhalb von 24 Stunden vor der ersten Behandlung abgeben. Zusätzlich müssen sie
zustimmen, eine angemessene Verhütungsform
während
der Studie zu befolgen
- – Keine
bekannte Allergie gegen Heparin oder gegen 8-Methoxypsoralen
-
B. Ausschlußkriterien
-
- – Patienten
unfähig,
mit den Screening- oder Behandlungsverfahren zu kooperieren
- – Patienten
mit einer hohen Wahrscheinlichkeit, aufgrund von Blutung, Abzeß oder Peritonitis
einen chirurgischen Eingriff zu benötigen
- – Patienten
mit klinisch relevanter Stenose des Magen-Darm-Traktes
- – Patienten
mit Intestinalstoma
- – Gleichzeitige
oder vorherige Einwirkung von Cyclosporin-A innerhalb der letzten
drei Monate der Behandlung
- – Keine
vorherige Einwirkung (innerhalb der letzten drei Monate) oder eine
stabile Dosis von Azathioprin innerhalb der letzten drei Monate
- – Mehr
als drei Antibiotikabehandlungsphasen mit Ciproxin oder Metronidazol über einen
Zeitraum von 14 Tagen, jeder innerhalb der letzten drei Monate,
mit bestätigter
Identifikation des Pathogens
- – Stillende
oder schwangere Frauen
- – Patienten
mit ernsthafter gleichzeitiger Erkrankung
- – Kardiovaskuläre Instabilität, die nicht
erlauben würde,
daß erforderliche
Blutvolumen während
der Photophorese abzunehmen
- – Behandlung
mit Arzneistoffen mit bekanntem photosensibilisierendem Potential
- – Patienten
mit schlechtem Venenzugang
- – Patienten
mit HIV-, Hbs-Antigen- oder HCV-Positivität
- – Patienten
mit den folgenden Laborbefunden:
- • Hämoglobin
von weniger als 10,5 g/dl
- • Thrombozyten
von weniger als 100 × 109/l
- • WBC <4000 × 109/l
- • Serumbilirubin >3 mg/dl
- • Serumcreatinin >2 mg/dl
- • Pt <60%, PTT >50 s
-
II. Beschreibung der Behandlungshäufigkeit
und Wirksamkeitsparameter
-
A. Behandlungshäufigkeit
und Wirksamkeitsbestimmungen
-
Vorphase 0
-
In
der Vorphase der Studie wurden die Patienten, die die Einschlußkriterien
erfüllten
oder die sie bei zukünftiger
Beobachtung erfüllen
könnten,
ausgewählt.
Retrospektive Dokumentation des steroidabhängigen Verlaufs der Erkrankung
des Patienten muß garantiert
sein.
-
Der
CDAI jedes Patienten wurde sechs Wochen vor dem Beginn der Studie
bestimmt. In den nächsten sechs
Wochen wurde der Patient bei der Erhaltungsdosis stabilisiert, die
die niedrigste Dosis Steroid war, die Inaktivitität der Crohn-Symptome
sicherstellt (definiert als ein CDAI <200 für zwei aufeinanderfolgende
Wochen). Die Patienten wurden in die Studie bei der Erhaltungsdosis
eingebracht, die > 10
mg Prednison pro Tag sein muß.
-
Weitere Überwachung
der Patienten fand innerhalb der ersten Woche vor dem Beginn der
Studie (Woche -1) statt.
-
Bewertung in Woche (-1):
-
- – Demographien
- – Geschichte
der Crohn-Krankheit
- – Lokalisierung
der Crohn-Krankheit
- – Geschichte
vorheriger chirurgischer Eingriffe
- – Vorherige
Behandlung auf Crohn-Krankheit
- – Dokumentation
des Belegs von Steroidabhängigkeit
aufgrund der Definition der Einschlußkriterien
- – Geschichte
und Physis
- – Laborbestimmung
(CBC mit Differential, ESR, CRP, 1-Säureglykoprotein, Serumelektrolyte,
Creatinin, BUN, SGOT, SGPT, Bilirubin, γ-GT, Serumglucose, PTT, PT und
Urinalyse)
- – Serum
eingefroren für
zukünftige
Studie
- – CDAI
- – Dokumentation
extraintestinaler Manifestationen von Crohn-Krankheit
- – Auflistung
gleichzeitiger Medikation
- – Harn-β-HCG-Test
(wenn zutreffend)
- – Compliancecheck
- – Dreifacher
Durchlässigkeitstest:
Saccharose, Lactulose, Mannitol
- – Lebensqualitätsindex
-
Vorphase I
-
Patienten,
die die Einschlußkriterien
erfüllten,
wurden in die Studie während
der sechsmonatigen Vorphase eingeführt. Prospektive Dokumentation
der Krankheitsaktivität
und der kumulativen Steroiddosis in der Vorphase muß garantiert
sein.
-
In
der Vorphase wurden kontinuierliche Versuche, die Steroiddosis zu
verringern, gemäß einem
fixierten Steroidverringerungsschema durchgeführt. Wiederholte Versuche wurden
durchgeführt,
die Dosis auf ein niedrigeres Niveau als die Erhaltungsdosis gemäß dem entsprechenden
Schema zu verringern. Die Erhaltungsdosis wurde in der tatsächlichen
Behandlungsphase permanent verringert.
-
Die
klinische Aktivität
des Patienten, gemessen durch CDAI, wurde als das Kriterium für die Entscheidung
verwendet, ob Steroide nach dem Steroid-Entwöhnungsschema abgesetzt wurden.
-
Steroidverringerung
begann mit dem ersten Behandlungstag in Phase 1. Die Dosierung wurde
verringert, indem die anfängliche
Steroiddosis mit dem nächstniedrigeren
Dosisniveau einer Standarddosierungsreihe (d.h. 50 mg, 37,5 mg,
25 mg, 15 mg, 10 mg, 5 mg) für
zwei Wochen abgewechselt wurde. Für die nächsten zwei Wochen wurde ein
Versuch unternommen, die Dosis auf dieses Niveau zu verringern.
Wenn die klinische Remission erhalten bleibt (kein Anstieg in CDAI >60 über dem anfänglichen Niveau oder >200 nach der zweiten
Woche), wurde die Steroiddosis für
vier Wochen um ein zusätzliches
Dosisniveau verringert, wie oben beschrieben.
-
Ein
Wiederauftreten der primären
Erkrankung (Anstieg in CDAI >60 über den
Startwert oder >200 über zwei
Wochen) wurde behandelt, indem die Steroiddosis auf das nächsthöhere Dosisniveau
der Dosierungsserie für
zwei Wochen vor dem Aufflackern rückgeführt wurde. Wenn klinische Remission
mit dieser Dosis nicht erreicht werden kann (CDAI <200 für zwei Wochen),
wird die Steroiddosis auf 50 mg pro Tag für eine Woche mit anschließender Verringerung
der Dosis gemäß dem Standard-Steroid-Entwöhnungsschema
erhöht.
Die Dosis wurde jedoch nur auf die Dosis erhöht, bei der eine klinische
Remission vor kurzem beobachtet wurde. Diese Dosis könnte von
der Erhaltungsdosis verschieden sein und wird als die „Remissionsstabilisierungsdosis" bezeichnet. Die
Dosis wird erneut gemäß dem Steroid-Entwöhnungsschema
verringert. Die Möglichkeit kann
nicht ausgeschlossen werden, daß die
Erhaltungsdosis am Ende der Behandlungsphase sich von derjenigen
der Vorphase der Studie unterscheidet.
-
Der
klinische Verlauf der Crohn-Krankheit des Patienten war für die letzten
zwei Wochen vor dem Beginn der Photopheresebehandlungsphase stabil.
-
In
den letzten zwei Wochen vor dem Beginn der Photopheresebehandlungsphase
wurde dem Patienten ein Crohn-Tagebuch zur Dokumentierung der mit
ihrer Erkrankung assoziierten Symptome gegeben.
-
In
der Vorphase wurde alle vier Wochen eine Blutprobe für CBC mit
Differential, Chemie, CRP und 1-Säureglykoprotein abgenommen.
-
Behandlungsphase
-
Photopheresebehandlungen
wurden an zwei aufeinanderfolgenden Tagen auf einer monatlichen
Basis für
sechs Monate durchgeführt.
-
Vor
dem ersten Behandlungstag bei jedem der monatlichen Besuche wurden
die folgenden Bestimmungen durchgeführt:
- – Bestimmung
des klinischen Status
- – CDAI
- – Dokumentation
extraintestinaler Symptome der Crohn-Krankheit
- – Dokumentation
der Steroiddosis und anderer gleichzeitiger Medikationen
- – Laborbestimmung:
Blutproben auf CBC mit Differential, Chemie, CRP und 1-Säureglykoprotein
- – Bestimmung
von Nebenwirkungen
- – Lebensqualitätsindex
- – Durchlässigkeitstest
(nur Monate 0 und 6)
- – Kolonoskopie
mit Biopsie ist fakultativ
-
Steroidverringerung
begann mit dem ersten Behandlungstag. Die Dosisverringerung beläuft sich
auf 5 mg Prednison in vier Wochen gemäß dem Standard-Steroid-Entwöhnungsschema.
Rückfälle von Crohn-Krankheit
mit CDAI-Werten von mehr als 450 führen zum Abbruch der Studie.
-
-
BEISPIEL 3
-
EXTRAKORPORALE PHOTOCHEMOTHERAPIE
BEI DER BEHANDLUNG VON PATIENTEN MIT INTERSTITIELLER CYSTITIS
-
I. Beschreibung der Patientenpopulation
-
Patienten,
die ein akutes Aufflackern ihrer interstitiellen Cystitis zeigen,
sind die Gegenstände
dieser klinischen Untersuchung. Um zur Einbeziehung in dieses Protokoll
eingeschlossen zu werden, sollen die folgenden Einschluß-/Ausschlußkriterien
erfüllt
werden:
-
A. Einschlußkriterien
-
- – Alter
zwischen 18 und 65
- – Schriftliches
oder mündliches
Einverständnis
in Gegenwart eines Zeugen, nachdem der Patient gründlich vom
behandelnden Arzt informiert worden ist.
- – Vor
Beginn der Behandlung müssen
alle Frauen im gebärfähigen Alter
einen dokumentierten negativen Serum-beta-HCG-Schwangerschaftstest
innerhalb von 24 Stunden vor der ersten Behandlung abgeben. Zusätzlich müssen sie
zustimmen, eine angemessene Verhütungsform
während
der Studie zu befolgen
- – Keine
bekannte Allergie gegen Heparin oder das 8-Methoxypsoralen
- – Patient
muß Schmerzen
in der Blase beim Füllen
oder Erleichterung beim Leeren der Blase haben – und-
- – Patient
muß suprapubische,
pelvine, urethrale, vaginale oder perineal Schmerzen haben – und
- – Patient
muß eine
Aufwachhäufigkeit
für das
Harnlassen >5-mal
pro Tag und nächtliches
Wasserlassen >2-mal
pro Nacht zeigen und
- – Patient
muß Glomerulation
nach Hydrodistention bei Zytoskopie zeigen – ODER – Hunner-Ulcus
-
B. Ausschlußkriterien
-
- – Patient
unfähig,
mit den Screening- oder Behandlungsverfahren zu kooperieren
- – Patient
mit gutartigen oder bösartigen
Blasentumoren
- – Patient
mit durch Bestrahlung, Bakterien oder Cyclophosphamid induzierter
Cystitis
- – Patienten
mit Vaginitis
- – Patienten
mit symptomatischem Harnröhrendivertikel
- – Patient
mit Gebärmutter-,
Gebärmutterhals-,
Vagina- oder Harnröhrenkrebserkrankungen
- – Patienten
mit aktivem Herpes
- – Patienten
mit Steinen in der Blase oder unteren Harnröhre
- – Symptome
von Cystitis werden gelindert durch Antibiotika, Harnröhrenantiseptika,
Harnröhrenanalgetika
- – Dauer
von Symptomen ist weniger als 12 Monate gewesen
- – Patient
hat unwillkürliche
Blasenkontraktionen durch Harnausscheidungen
- – Bei
einer Blasenkapazität
von 400 ml besteht ein Nicht-Vorhandensein sensorischen Harndrangs
- – Stillende
oder schwangere Frauen
- – Patienten
mit schwerwiegender gleichzeitiger Erkrankung
- – Kardiovaskuläre Instabilität, die nicht
erlauben würde,
das erforderliche Blutvolumen während
der Photopherese abzunehmen
- – Behandlung
mit Arzneistoffen mit bekanntem photosensibiliserenden Potential
- – Patienten
mit schlechtem Venenzugang
- – Patienten
mit HIV-, Hbs-Antigen- oder HCV-Positivität
- – Patienten
mit den folgenden Laborbefunden:
- • Hämoglobin
von weniger als 10,5 g/dl
- • Thrombozyten
von weniger als 100 × 109/l
- • WBC <4000 × 109/l
- • Serumbilirubin >3 mg/dl
- • Serumcreatinin >2 mg/dl
- • Pt <60%, PTT >50 s
-
II. Beschreibung der Behandlungshäufigkeit
und Wirksamkeit
-
Photopheresebehandlungen
werden an zwei aufeinanderfolgenden Tagen wöchentlich für vier Wochen (8 Photophoresebehandlungen)
durchgeführt
und werden dann an zwei aufeinanderfolgenden Tagen jede zweite Woche
für die
nächsten
acht Wochen (8 zusätzliche
Behandlungen) für
insgesamt 16 Photophoresevorgänge über 12 Wochen
durchgeführt.
Photopherese wird nach 12 Wochen auf eine Häufigkeit von monatlich und
darüber
hinaus entwöhnt,
in Abhängigkeit
von der Langzeitreaktion des Patienten. Die Behandlung kann erneut
eingeleitet werden, um ein Aufflackern der Erkrankung zu behandeln.
-
Eine
signifikante Verringerung des Schmerzes, der Hämaturie und der Häufigkeit
des Harnlassens wird resultierend aus der Behandlungsmethode dieser
Erfindung erwartet. Die Art und Menge gleichzeitiger Medikationen,
die die Patienten zur Behandlung von IC benötigen, wird verringert, was
zu einem Gesamtanstieg der Lebensqualität und einer Verminderung der
Erkrankung führt.