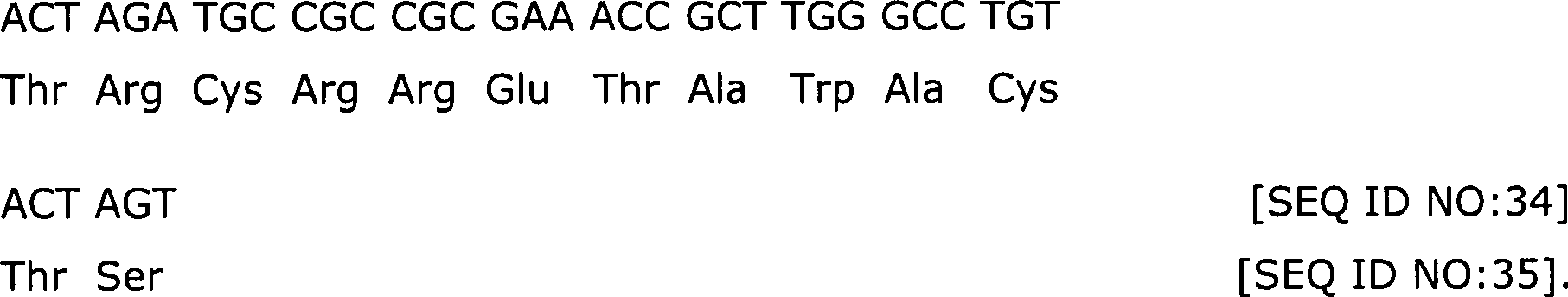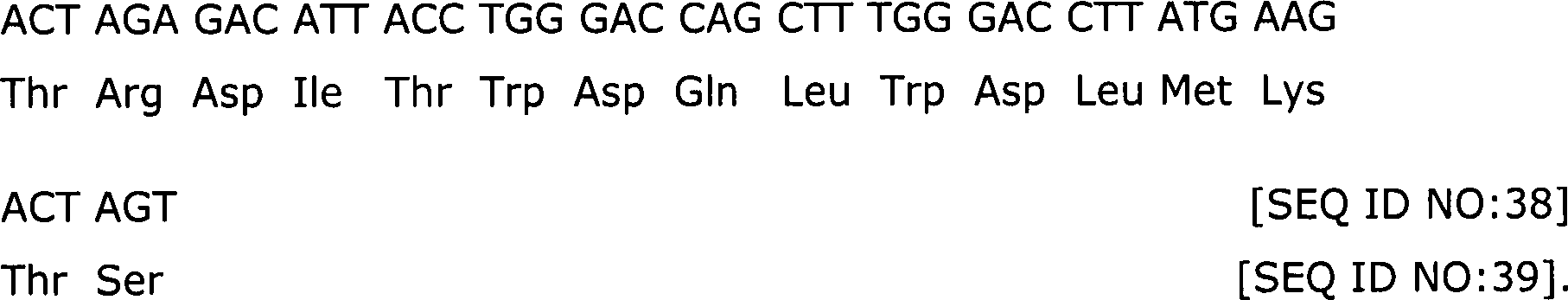-
TECHNISCHES GEBIET DER ERFINDUNG
-
Die
vorliegende Erfindung betrifft ein chimäres Adenovirus-Fiberprotein,
welches eine eingeschränkte nicht-native
Aminosäuresequenz
umfasst. Die nicht-native
Aminosäuresequenz
codiert ein Peptid-Motiv, welches ein Epitop für einen Antikörper oder
einen Liganden für
einen Zelloberflächenrezeptor
umfasst, welches zum Zell-Targeting verwendet werden kann. Die vorliegende
Erfindung betrifft ferner Vektoren, welche ein derartiges chimäres Adenovirus-Fiberprotein
umfassen, und Verfahren zur Verwendung derartiger Vektoren.
-
HINTERGRUND DER ERFINDUNG
-
Trotz
ihrer vorher schlechten Reputation als Hauptkrankheitserreger, welche
zu zahlreichen Infektionskrankheiten führen, haben Adenoviren (und
insbesondere replikationsdefiziente Adenoviren) in jüngerer Zeit
beträchtliche
Anerkennung als hocheffektive virale Vektoren für die Gentherapie erlangt.
Adenovirale Vektoren bieten aufregende Möglichkeiten auf diesem neuen
Gebiet der Therapeutik, basierend auf ihrer hohen Gentransfereffizienz,
ihrer beträchtlichen
Transportkapazität
und ihrer Fähigkeit,
ein breites Spektrum an Zelltypen zu infizieren (Crystal, Science,
270, 404–410
(1995); (Curiel et al., Human Gene Therapy, 3, 147–154 (1992);
Internationale Patentanmeldung
WO
95/21259 ).
-
Aufgrund
dieser wünschenswerten
Eigenschaften von Adenoviren hat man rekombinante adenovirale Vektoren
für den
zellgerichteten Transfer eines oder mehrerer rekombinanter Gene
in erkrankte Zellen oder Gewebe, die der Behandlung bedürfen, verwendet.
Mit Bezug auf die allgemeine Struktur eines Adenovirus unter dem
Elektronenmikroskop ähnelt
ein Adenovirus-Partikel einer Raumkapsel mit abstehenden Antennen (Xia
et al., Structure, 2, 1259–1270
(1994)). Das virale Kapsid umfasst mindestens sechs verschiedene
Polypeptide, umfassend 240 Kopien des trimeren Hexons (d. h. Polypeptid
II) und jeweils 12 Kopien der pentameren Penton-(Polypeptid III-)Basis
und der trimeren Fiber (Xia et al., supra).
-
Ein
Adenovirus verwendet zwei separate Zellrezeptoren, die beide präsent sein
müssen,
um an eine Zelle anzuheften und sie zu infizieren (Wickham et al.,
Cell, 73, 309–319
(1993)). Als Erstes heftet das Adenovirus-Fiberprotein das Virus
an eine Zelle durch Bindung an einen bisher noch unidentifizierten
Rezeptor. Sodann bindet die Pentonbasis an αV-Integrine,
die eine Familie von heterodimeren Zelloberflächenrezeptoren sind, welche
zelluläre
Adhäsion
an die extrazellulären
Matrixmoleküle
sowie andere Moleküle
vermitteln (Hynes, Cell, 69, 11–25
(1992)). Wenn ein Adenovirus einmal an eine Zelle angeheftet ist,
durchläuft
es Rezeptor-vermittelte Internalisierung in Clathrin-"coated" endocytische Vesikel
und wird schrittweise zerlegt bis auf das virale doppelsträngige Genom,
und sodann wird das Genom (und einige begleitende virale Komponenten) zu
dem Zellkern transportiert und somit eine Infektion initiiert (Svennson
et al., J. Virol., 51, 687–694
(1984); Chardonnet et al., Virology, 40, 462–477 (1970); Greber et al.,
Cell, 75, 477–486
(1993); Fitzgerald et al., Cell, 32, 607–617 (1983)).
-
Das
Fiber-Monomer besteht aus einem aminoterminalen Schwanz (welcher
nicht-kovalent an die Pentonbasis anheftet), einem Schaft (dessen
Länge zwischen
verschiedenen Virus-Serotypen variiert), und einer carboxyterminalen
globulären
Knob-Domäne
(die notwendig und ausreichend ist für Wirtszellbindung) (Devaux
et al., J. Molec. Biol., 215, 567–588 (1990); Xia et al., supra;
Green et al., EMBO J., 2, 1357–1365
(1983); Henry et al., J. Virology, 68(8), 5239–5246 (1994)). Die Regionen,
welche notwendig sind für
die Fiber-Trimerisierung (die für
die Pentonbasis-Bindung erforderlich ist), sind ebenfalls in der
Knob-Region des Proteins lokalisiert (Henry et al. (1994), supra;
Novelli et al., Virology, 185, 365–376 (1991)). Die Fiber und
das Hexon bestimmen zusammen die Serotyp-Spezifität des Virus
und umfassen ferner die Haupt-Antigendeterminanten des Virus (Watson
et al., J. Gen. Virol., 69, 525–535
(1988)).
-
Diese
Fähigkeit
der adenoviralen Fiber und des Hexon-Proteins, als Ziele für eine Wirtsimmunantwort zu
fungieren, hat anfänglich
die Versuche zur adenoviral vermittelten Gentherapie behindert.
Namentlich sind Änderungen
in der Genexpression, welche durch Adenovirus vermittelt wird, nicht
permanent, weil der Vektor nicht stabil aufrechterhalten wird. Jedoch
können
nach einer Readministration des adenoviralen Vektors, um die therapeutische
Antwort zu prolongieren, neutralisierende Antikörper gegen die adenovirale
Fiber und/oder Hexon-Proteine hervorgerufen werden und so die Proteinproduktion
umgangen werden (Wohlfart, J. Virology, 62, 2321–2328 (1988); Wohlfart et al.,
J. Virology, 56, 896–903
(1985)). Glücklicherweise
wird eine derartige Immunantwort nicht bei allen Verwendungen von
adenoviralen Vektoren erzeugt. Ähnlich
ist nun bekannt, dass, wenn die Gegenwart derartiger neutralisierender
Antikörper
adenoviral vermitteltes intrazelluläres Delivery verhindert, statt
dessen ein anderer adenoviraler Vektor, z. B. ein adenoviraler Vektor
anderen Serotyps oder ein anderer Adenovirus-Vektor, dem das Epitop
fehlt, gegen das der Antikörper
gerichtet ist, verwendet werden kann (Crompton et al., J. Gen. Virol.,
75, 133–139
(1994)). Ferner tauchen ständig
neuere und effektive Techniken auf, um zu verhindern, dass eine
Antikörperantwort
gegen das Virus eine effektive Readministration eines adenoviralen
Vektors ausschließt
(siehe z. B. die Internationale Patentanmeldung
WO 96/12406 ; Mastrangeli et al.,
Human Gene Therapy, 7, 79–87
(1996)).
-
Die
adenoviral vermittelte Gentherapie bleibt also weiterhin sehr vielversprechend,
insbesondere mit Bezug auf das Umdirigieren des Adenovirus-Tropismus.
Namentlich, obschon Adenovirus in eine beeindruckende Vielfalt von
Zelltypen eintreten kann (siehe z. B. Rosenfeld et al., Cell, 68,
143–155
(1992); Quantin et al., Proc. Natl. Acad. Sci., 89, 2581–2584 (1992));
Lemarchand et al., Proc. Natl. Acad. Sci., 89, 6482–6486 (1992);
Anton et al., J. Virol., 69, 4600–4606 (1995); LaSalle et al.,
Science, 259, 988–990
(1993)), scheint es immer noch Zellen zu geben (z. B. Lymphocyten),
die nicht leicht zugänglich
sind für
Adenovirus-vermitteltes Gen-Delivery (siehe z. B. Grubb et al.,
Nature, 371, 802–806
(1994); Dupuit et al., Human Gene Therapy, 6, 1185–1193 (1995);
Silver et al., Virology, 165, 377–387 (1988); Horvath et al.,
J. Virol., 62(1), 341–345
(1988)). Ähnlich
hat man auch beim Targeting auf Zellen, die leicht von Adenovirus
infiziert werden, in vielen Fällen
sehr hohe Levels von Adenovirus-Partikeln verwendet, um Transduktion
zu erzielen. Dies ist nachteilig insofern, als jegliche Immunantwort,
die mit adenoviraler Infektion assoziiert ist, zwangsläufig verschlimmert
würde bei
Verwendung solch hoher Levels.
-
Demgemäß suchen
Forscher nach neuen Wegen zum selektiven Einführen von Adenoviren in Zellen, welche
durch Adenoviren nicht infiziert werden können, und zum Erhöhen der
Effektivität
von adenoviralem Delivery in Zellen, welche von Adenoviren infiziert
werden. Das allgemeine Prinzip des Umdirigierens des Adenovirus-Tropismus
ist "straightforward". Bei einem üblichen
Ansatz kann durch Inkorporation von Peptidbindungsmotiven in ein
Adenovirus-Coat-Protein, z. B. Fiberprotein, das Virus so umdirigiert
werden, dass es an eine Zelloberflächen-Bindungsstelle bindet,
an die es normalerweise nicht bindet (siehe z. B. Michael et al., Gene
Therapy, 2, 660–668
(1995); Internationale Patentanmeldung
WO 95/26412 ; Internationale Patentanmeldung
WO 94/10323 ; Internationale
Patentanmeldung
WO 95/05201 ).
Ein Peptidbindungsmotiv ist eine kurze Sequenz von Aminosäuren, z.
B. ein Epitop für
einen Antikörper
(z. B. einen bispezifischen Antikörper), oder ein Ligand für eine Zelloberflächen-Bindungsstelle
(z. B. einen Rezeptor), welches zum Zell-Targeting verwendet werden
kann. Wenn das Peptidmotiv bindet, z. B. an seine korrespondierende
Zelloberflächen-Bindungsstelle,
an die Adenovirus normalerweise nicht oder nur mit geringer Affinität bindet,
dann kann das Adenovirus, welches das Peptidmotiv trägt, auf
spezifische und/oder effizientere Weise selektiv Gene in die Zelle
liefern, welche diese Bindungsstelle umfasst.
-
Jedoch
ist die Maßnahme,
ein bekanntes Peptidmotiv einfach in das Fiberprotein eines Adenovirus
zu inkorporieren, möglicherweise
nicht ausreichend, um dem Virus zu gestatten, eine Zielzelle zu
binden und sie effektiv zu transduzieren. Die Effektivität des Peptidmotivs
beim Umdirigieren der Virusbindung auf eine neue Zelloberflächen-Bindungsstelle
hängt von
mehreren Faktoren ab, einschließlich
der Verfügbarkeit
des Peptidmotivs zum Binden an den Zelloberflächenrezeptor, der Affinität des Peptidmotivs
für die
Zelloberflächen-Bindungsstelle
und der Anzahl von Zielbindungsstellen (z. B. Rezeptoren), welche
auf der Zelle präsent
sind, auf die das Gen-Delivery zielgerichtet ist. Während der
letztgenannte Faktor derzeit nicht manipuliert werden kann in in-vivo-Applikationen, scheinen
die beiden erstgenannten Raum für
Verbesserungen zu bieten hinsichtlich der vorherrschenden adenoviral
vermittelten Gentherapie. Zum Beispiel haben frühere Forscher nicht berücksichtigt,
dass, wenn das Peptidmotiv innerhalb der Struktur des Fiberproteins
verdeckt ("buried") und/oder durch
die umgebende Struktur des Proteins maskiert ist, das Peptidmotiv
nicht in der Lage sein wird, mit seinem Ziel zu interagieren und
es zu binden. Ähnlich
haben frühere
Forscher nicht angesprochen, dass es die Affinität des Peptidmotivs für die Zelloberflächen-Bindungsstelle
(z. B. den Rezeptor) ist, die bestimmt, wie effizient das Virus
einen Bindungskontakt mit dem Zielrezeptor initiieren und aufrechterhalten
kann, so dass Zellinfektion/-transduktion resultiert.
-
Es
besteht also weiterhin Bedarf an verbesserten Verfahren zum Zell-Targeting
und an adenoviralen Vektoren, durch welche dieses erreicht werden
kann. Die vorliegende Erfindung sucht mindestens einige der im Vorstehenden
genannten Probleme rekombinanter adenoviraler Gentherapie zu überwinden.
Insbesondere liegt ein Ziel der vorliegenden Erfindung in der Bereitstellung
verbesserter Vektoren und Verfahren zum Zell-Targeting durch Bereitstellung
eines chimären
Adenovirus-Fiberproteins, welches ein eingeschränktes Peptidmotiv umfasst.
Diese und weitere Ziele und Vorteile der vorliegenden Erfindung
sowie zusätzliche
erfindungsgemäße Merkmale
ergeben sich aus der nachfolgenden Detailbeschreibung.
-
KURZE ZUSAMMENFASSUNG DER
ERFINDUNG
-
Die
vorliegende Erfindung stellt ein chimäres Adenovirus-Fiberprotein
bereit, welches sich von dem wildtypischen (d. h. nativen) Adenovirus-Fiberprotein
unterscheidet durch die Einführung
einer nicht-nativen Aminosäuresequenz
in einer konformationell beschränkten
(d. h. eingeschränkten)
Weise, wobei die nicht-native Aminosäuresequenz durch die Anwesenheit
einer RGD-Sequenz und eines oder mehrerer Cystein-Paare eingeschränkt ist
und wobei die nicht-native
Aminosäuresequenz
zur Bildung einer nicht-präexistierenden Schleife
infolge Interaktion zwischen den Cysteinen befähigt ist oder in die oder an
Stelle der nativen Aminosäuresequenz
einer präexistierenden
Schleife des Wildtyp-Adenovirus-Fiberproteins inseriert ist.
-
Die
Einführung
resultiert in der Insertion oder Erzeugung eines eingeschränkten Peptidmotivs,
welches dem resultierenden chimären
Adenovirus-Fiberprotein eine Fähigkeit
verleiht, einen Zelleintritt eines Vektors zu dirigieren, welcher
das chimäre
Fiberprotein umfasst, der effizienter ist als der Zelleintritt eines
Vektors, welcher bis auf die Tatsache, dass er ein Wildtyp-Adenovirus-Fiberprotein umfasst,
identisch ist, und/oder eine Fähigkeit,
den Eintritt in Zellen zu dirigieren, die Adenovirus, welches das
Wildtyp-Fiberprotein umfasst, typischerweise nicht infiziert/transduziert.
Die vorliegende Erfindung stellt ferner Vektoren bereit, welche
das chimäres
Adenovirus-Fiberprotein umfassen, und Verfahren zur Konstruktion
und Verwendung derartiger Vektoren.
-
KURZBESCHREIBUNG DER FIGUREN
-
1 ist
ein Diagramm, welches das erfindungsgemäße Verfahren illustriert zum
Targeting von Adenovirus durch konformationelle Beschränkung einer
nicht-nativen Aminosäuresequenz
in einer exponierten Schleife des Fiber-Knob, um ein Peptidbindungsmotiv zu
umfassen.
-
2 ist
ein Diagramm, welches das erfindungsgemäße Verfahren illustriert zum
Targeting von Adenovirus durch Inkorporieren einer konformationell
eingeschränkten
nicht-nativen Aminosäuresequenz
(d. h. einer Sequenz, welche eine nicht-präexistierende Schleife umfasst)
in den C-Terminus des Fiberproteins, um ein Peptidbindungsmotiv
zu umfassen.
-
3 ist
ein Diagramm, welches das Plasmid p193(F5*) zeigt, das zur Konstruktion
von Adenovirus-Fiber-Chimären
verwendet wird.
-
4 ist
ein Diagramm, welches das Plasmid p193 F5F2K zeigt, das ein chimäres Fiberprotein
codiert.
-
5 ist
ein Diagramm, welches das Plasmid p193 F5F2K(RKKK2) zeigt, das ein
chimäres
Adenovirus-Fiberprotein codiert, umfassend die Heparin-Bindungsdomäne (d. h.
RKKKRKKK) oder Arg Lys Lys Lys Arg Lys Lys Lys [SEQ ID NO:1]) in
der exponierten HI-Schleife des Ad2-Fiber-Knob.
-
6 ist
ein Diagramm, welches das Plasmid p193 F5F2K(FLAG) zeigt, das ein
chimäres
Adenovirus-Fiberprotein codiert, umfassend das FLAG-Epitop (d. h.
DYKDDDDK oder Asp Tyr Lys Asp Asp Asp Asp Lys [SEQ ID NO:2]) in
der exponierten HI-Schleife des Ad2-Fiber-Knob.
-
7 ist
ein Balkendiagramm, welches β-Galactosidase-Expression
(% Kontrolle) in 293-Zellen zeigt, transduziert entweder mit AdZ.F5F2K(RKKK2)
(geschlossene Balken) oder AdZ (offene Balken) in der Abwesenheit
(Kontrolle) oder in der Anwesenheit (Fiber) von löslichem
Fiberprotein.
-
8 zeigt
das Transfer-Plasmid p193(F5)RGD, welches zur Erzeugung des Adenovirus-Vektors AdZ.RGD
verwendet wurde.
-
9 zeigt
das Transfer-Plasmid p193(F5)pLDV, welches zur Erzeugung des Adenovirus-Vektors AdZ.pLDV
verwendet wurde.
-
10 zeigt das Transfer-Plasmid p193(F5)pYIGSR,
welches zur Erzeugung des Adenovirus-Vektors AdZ.pYIGSR verwendet
wurde.
-
11 ist eine Auftragung von Tage post Infektion
gegen FFU/Zelle für
293-Zellen, infiziert
mit AdZ (offene Kreise) oder AdZ.RGD (geschlossene Quadrate).
-
12 ist eine Auftragung von zugegebenen Viruspartikeln
(pro 6 cm-Platte)
gegen β-Galactosidase-Expression
(RLU/0,3 μl/7
min) für
A549-Zellen, infiziert mit AdZ (geschlossene Kreise) oder AdZ.RGD
(geschlossene Dreiecke).
-
13 ist eine Auftragung von zugegebenen Viruspartikeln
(pro 6 cm-Platte)
gegen β-Galactosidase-Expression
(RLU/0,3 μl/7
min) für
CPAE-Zellen, infiziert mit AdZ (geschlossene Kreise) oder AdZ.RGD
(geschlossene Dreiecke).
-
14 ist eine Auftragung von zugegebenen Viruspartikeln
(pro 6 cm-Platte)
gegen β-Galactosidase-Expression
(RLU/0,3 μl/7
min) für
HISM-Zellen, infiziert mit AdZ (geschlossene Kreise) oder AdZ.RGD
(geschlossene Dreiecke).
-
15 ist ein Balkendiagramm, welches die Bindung
von AdZ.RGD (geschlossene Balken) und AdZ (offene Balken) zeigt,
ausgedrückt
als % Input von zellgebundenem Vektor in 835-Nierenzellen entweder
in der Abwesenheit (Kontrolle) oder in der Anwesenheit von kompetierendem
Fiberprotein (F5), Pentonbasis-Protein (PB) oder sowohl Fiber- als
auch Pentonbasis-Protein (F5/PB).
-
16 ist ein Balkendiagramm, welches die Bindung
von AdZ.RGD (geschlossene Balken) und AdZ (offene Balken) zeigt,
ausgedrückt
als % Input von zellgebundenem Vektor in A10-Glattmuskelzellen entweder in
der Abwesenheit (Kontrolle) oder in der Anwesenheit von kompetierendem
Fiberprotein (F5), Pentonbasis-Protein (PB) oder sowohl Fiber- als
auch Pentonbasis-Protein (F5/PB).
-
17 ist ein Balkendiagramm, welches die Bindung
von AdZ.RGD (geschlossene Balken) und AdZ (offene Balken) zeigt,
ausgedrückt
als % Input von zellgebundenem Vektor in CPAE-Endothelzellen entweder in
der Abwesenheit (Kontrolle) oder in der Anwesenheit von kompetierendem
Fiberprotein (F5), Pentonbasis-Protein (PB) oder sowohl Fiber- als
auch Pentonbasis-Protein (F5/PB).
-
18 ist ein Balkendiagramm, welches β-Galactosidase-Expression
(% Kontrolle) in A549-Zellen, transduziert entweder mit AdZ.pYIGSR
(geschlossene Balken) oder AdZ (offene Balken) in der Abwesenheit (Kontrolle)
oder in der Anwesenheit (Fiber) von löslichem Fiberprotein zeigt.
-
19 ist ein Balkendiagramm, welches β-Galactosidase-Expression
(% Kontrolle) in Ramos-Zellen, transduziert entweder mit AdZ.pLDV
(geschlossene Balken) oder AdZ (offene Balken) in der Abwesenheit (Kontrolle)
oder in der Anwesenheit (Fiber) von löslichem Fiberprotein oder Fiberprotein
und EDTA (Fiber + EDTA) zeigt.
-
20 ist ein Balkendiagramm, welches β-Galactosidase-Expression
(% Kontrolle) in 293-Zellen, transduziert entweder mit AdZ.RGD (geschlossene
Balken), AdZ.pRGD (gestrichelte Balken) oder AdZ (offene Balken)
in der Abwesenheit (Kontrolle) oder in der Anwesenheit (Fiber) von
löslichem
Fiberprotein zeigt.
-
DETAILBESCHREIBUNG DER ERFINDUNG
-
Die
vorliegende Erfindung stellt u. a. ein rekombinantes Adenovirus
bereit, welches ein chimäres
Fiberprotein umfasst. Das chimäre
Fiberprotein umfasst eine eingeschränkte nicht-native Aminosäuresequenz zusätzlich zu
oder an Stelle einer nativen Aminosäuresequenz. Diese nicht-native
Aminosäuresequenz
erlaubt der chimären
Fiber (oder einem Vektor, welcher die chimäre Fiber umfasst), effizienter
an Zellen zu binden und in sie einzutreten.
-
Chimäres Adenovirus-Fiberprotein
-
Ein "Fiberprotein" gemäß der Erfindung
umfasst vorzugsweise ein adenovirales Fiberprotein. Ein beliebiger
der Serotypen von humanem oder nicht-humanem Adenovirus (wie später im Kontext
des Vektors, welcher ein chimäres
Fiberprotein umfasst, beschrieben) kann als Quelle für das Fiberprotein
oder Fiber-Gen verwendet
werden. Optimalerweise aber ist das Adenovirus ein Ad2- oder Ad5-Adenovirus.
-
Das
Fiberprotein ist "chimär" insofern, als es
Aminosäurereste
umfasst, welche nicht typischerweise in dem Protein gefunden werden,
wie es aus Wildtyp-Adenovirus (d. h. umfassend das native Protein
oder Wildtyp-Protein) isoliert wird. Das Fiberprotein umfasst also
eine "nicht-native
Aminosäuresequenz". Mit "nicht-native Aminosäuresequenz" ist eine Sequenz
von beliebiger geeigneter Länge,
vorzugsweise ca. 3 bis ca. 200 Aminosäuren, optimalerweise ca. 3
bis ca. 30 Aminosäuren,
gemeint. Wünschenswerterweise
wird die nicht-native Aminosäuresequenz
in das Fiberprotein auf der Genexpressionsebene eingeführt (d.
h. durch Einführung
einer "Nucleinsäuresequenz,
welche eine nicht-native
Aminosäuresequenz
codiert"). Eine
derartige nicht-native Aminosäuresequenz
wird entweder an Stelle von adenoviralen Sequenzen oder zusätzlich zu
adenoviralen Sequenzen eingeführt.
Unabhängig
von der Natur der Einfüh rung
resultiert ihre Integration in ein adenovirales Fiberprotein auf
der Ebene von entweder DNA oder Protein in der Erzeugung eines Peptidmotivs (d.
h. eines Peptidbindungsmotivs) in dem resultierenden chimären Fiberprotein.
-
Das
Peptidmotiv erlaubt Zell-Targeting, z. B. dadurch, dass es ein Epitop
für einen
Antikörper
oder einen Liganden für
eine Zelloberflächen-Bindungsstelle
umfasst. Das Peptidmotiv kann optional andere Elemente zur Verwendung
zum Zell-Targeting umfassen (z. B. eine "Single-Chain"-Antikörper-Sequenz). Das Peptidmotiv
kann durch die Insertion generiert werden und kann z. B. native
und nicht-native Sequenzen umfassen oder vollständig aus nicht-nativen Sequenzen
bestehen. Das Peptidmotiv, welches aus der Insertion der nicht-nativen Aminosäuresequenz
in das chimäre
Fiberprotein resultiert, kann entweder ein Hochaffinitätspeptid
(d. h. ein Peptid, welches seine kognate Bindungsstelle bindet,
wenn es bei einer relativ niedrigen Konzentration bereitgestellt
wird) oder ein Niederaffinitätspeptid
(d. h. ein Peptid, welches seine kognate Bindungsstelle bindet,
wenn es bei einer relativ hohen Konzentration bereitgestellt wird),
sein. Vorzugsweise ist das resultierende Peptidmotiv jedoch ein
Hochaffinitätsmotiv,
insbesondere ein Motiv, welches von hoher Affinität für seine
kognate Bindungsstelle geworden ist infolge seiner Einschränkung innerhalb
des Adenovirus-Fiberproteins.
-
Ein "Antikörper" umfasst, ist aber
nicht beschränkt
auf Immunglobulin-Moleküle
und immunologisch aktive Bereiche von Immunglobulin-Molekülen, z.
B. Bereiche, welche ein Paratop (d. h. eine Antigen-Bindungsstelle)
enthalten. Insbesondere kann ein Antikörper vorzugsweise ein bispezifischer
Antikörper
sein, d. h. mit einem Paratop, das auf ein Epitop des chimären Fiberproteins
gerichtet ist, und einem anderen Paratop, das auf ein Epitop einer
Zelloberflächen-Bindungsstelle
gerichtet ist.
-
Eine "Zelloberflächen-Bindungsstelle" umfasst einen Rezeptor
(der vorzugsweise ein Protein, Kohlenhydrat, Glycoprotein oder Proteoglycan
ist) sowie ein beliebiges entgegengesetzt geladenes Molekül (d. h.
entgegengesetzt geladen mit Bezug auf das chimäre Coat-Protein) oder einen
anderen Typ von Molekül,
mit dem das chimäre
Coat-Protein interagieren kann, um die Zelle zu binden und dadurch
den Zelleintritt zu fördern. Beispiele
für potentielle
Zelloberflä chen-Bindungsstellen
umfassen, sind aber nicht beschränkt
auf: Heparin- und Chondroitinsulfatreste, welche auf Glycosaminoglycanen
vorkommen; Sialinsäurereste,
welche auf Mucinen, Glycoproteinen und Gangliosiden vorkommen; Haupthistokompatibilitätskomplex
I-(MHC I)-Glycoproteine; die üblichen
Kohlenhydrat-Komponenten, die in Membranglycoproteinen vorkommen,
einschließlich
Mannose, N-Acetylgalactosamin, N-Acetylglucosamin, Fucose, Galactose
und dergleichen. Jedoch sind ein erfindungsgemäßes chimäres Fiberprotein und Verfahren
zu seiner Verwendung nicht auf einen besonderen Mechanismus zellulärer Interaktion
(d. h. Interaktion mit einer besonderen Zelloberflächen-Bindungsstelle)
beschränkt
und sind nicht so auszulegen.
-
Eine
erfindungsgemäße Zelloberflächen-Bindungsstelle
ist vorzugsweise eine Bindungsstelle, die zuvor einer Interaktion
mit einem Wildtyp-Adenovirus-Fiberprotein nicht oder nur auf einem
sehr niedrigen Niveau zugänglich
war, wie es in der reduzierten Eintrittseffizienz eines Wildtyp-Adenovirus-Fiberprotein
enthaltenden Vektors im Vergleich zu einem Vektor, welcher ein chimäres Adenovirus-Fiberprotein
gemäß der Erfindung
umfasst, widergespiegelt wird. Die Insertion der nicht-nativen Aminosäuresequenz
in das chimäre
Fiberprotein verleiht dem chimären
Fiberprotein also wünschenswerterweise
eine Fähigkeit,
an eine auf einer Zelloberfläche
präsente
Bindungsstelle zu binden, welche Wildtyp-Fiberprotein nicht oder
nur mit sehr niedriger Affinität bindet.
Dies resultiert vorzugsweise in einer Situation, worin das chimäre Adenovirus-Fiberprotein in der
Lage ist, einen Zelleintritt eines Vektors zu dirigieren über die
Interaktion der nicht-nativen Aminosäure – entweder direkt oder indirekt – mit einem
zellulären
Rezeptor, der von dem Fiber-Rezeptor verschieden ist.
-
Dies
resultiert ferner vorzugsweise in einer Situation, worin das chimäre Adenovirus-Fiberprotein
in der Lage ist, einen Zelleintritt eines Vektors zu dirigieren,
welcher die chimäre
Adenovirus-Fiber umfasst, der effizienter ist als der Zelleintritt
eines Vektors, der bis auf die Tatsache, dass er ein Wildtyp-Adenovirus-Fiberprotein
an Stelle des chimären
Adenovirus-Proteins umfasst, identisch ist. Ferner vorzugsweise
kann das chimäre
Adenovirus-Fiberprotein eine Erhöhung
der Targeting-Spezifität
bewirken, z. B. durch Ändern
der Spezifität
des Fiberproteins.
-
Die "Eintrittseffizienz" kann durch verschiedene
Mittel quantitativ bestimmt werden. Insbesondere kann die Eintrittseffizienz
quantitativ bestimmt werden durch Einführen eines chimären Fiberproteins
in einen Vektor, vorzugsweise in einen viralen Vektor, und Überwachen
des Zelleintritts (z. B. durch Vektor-vermitteltes Delivery eines
Gens, z. B. eines Reportergens, in eine Zelle) als eine Funktion
der Multiplizität
der Infektion (MOI). In diesem Fall zeigt ein reduzierter erforderlicher
MOI-Wert für
den Zelleintritt eines Vektors, welcher ein chimäres adenovirales Fiberprotein
umfasst, im Vergleich zu einem Vektor, der bis auf die Tatsache,
dass er ein Wildtyp-Adenovirus-Fiberprotein an Stelle des chimären Adenovirus-Fiberproteins
umfasst, identisch ist, einen "effizienteren" Eintritt an.
-
Ähnlich kann
die Eintrittseffizienz quantitativ bestimmt werden mit Bezug auf
die Zellbindungsfähigkeit von
Vektoren, welche chimäre
oder Wildtyp-Fiberproteine enthalten, oder von den löslichen
chimären
oder Wildtyp-Fiberproteinen selbst. In diesem Fall ist eine erhöhte Bindung,
welche für
den Vektor, der ein chimäres adenovirales
Fiberprotein enthält,
oder das chimäre
Fiberprotein selbst gezeigt wird, im Vergleich zu dem identischen
Vektor, der statt dessen ein Wildtyp-Fiberprotein enthält, oder
dem Wildtyp-Fiberprotein selbst, indikativ für eine erhöhte Eintrittseffizienz oder
einen "effizienteren" Eintritt.
-
Gemäß vorliegender
Erfindung ist eine nicht-native Aminosäuresequenz konformationell
beschränkt oder "eingeschränkt". Eine nicht-native
Aminosäuresequenz
ist eingeschränkt,
wenn sie in einem chimären
Fiberprotein präsent
ist und einer Zelle in einer solchen Weise präsentiert wird, dass die Fähigkeit
des chimären Fiberproteins,
an die Zelle zu binden und/oder Zelleintritt zu vermitteln, erhöht wird,
z. B. relativ zu dem Wildtyp-Protein. Eine derartige Einschränkung gemäß vorliegender
Erfindung wird erzielt durch die Platzierung einer nicht-nativen
Aminosäuresequenz
in einer exponierten Schleife des chimären Fiberproteins oder durch
die Platzierung der Sequenz in einer anderen Lokalisation und Erzeugung
einer schleifenartigen Struktur, umfassend die nicht-native Aminosäuresequenz
an dieser Stelle.
-
Adenoviral
vermitteltes Gen-Delivery in spezifische Gewebe (d. h. Zell-Targeting)
ist bisher durch die Tatsache behindert worden, dass, allgemein,
unein geschränkte
Peptide niedrigerer Affinität
oft nicht so effektiv sind in der Vermittlung von Adenovirus-Bindung
an Zielrezeptoren wie eingeschränkte
Peptide. Beispielsweise werden durch Phagen-Display oder allgemein
identifizierte Peptidmotive in einer eingeschränkten Umgebung präsentiert.
Demgemäß stellt
die vorliegende Anmeldung ein Mittel bereit zum Targeting von Adenovirus,
wobei in einer Ausführungsform
die Peptidmotive in der eingeschränkten Umgebung der Schleifendomänen des Knob
des Adenovirus-Fiberproteins präsentiert
werden.
-
Dieses
Verfahren ist vorteilhaft, weil nicht alle Reste der exponierten
Fiber-Knob-Schleifen
kritisch sind für
den Zusammenbau oder die Funktion des Fiberproteins und somit günstige Stellen
bereitstellen, an denen die Peptidmotive inseriert werden können. Dieses
Verfahren ist ferner vorteilhaft insofern, als Hinzufügungen innerhalb
einer Schleife einer Proteinstruktur resistenter gegen proteolytische
Degradation sein werden als Hinzufügungen am Ende eines Proteins.
Weiter: insbesondere für
Niederaffinitäts-Peptidmotive
ist dieses Verfahren effizienter als das Verfahren, bei dem die
Peptidmotive als uneingeschränkte
lineare Strukturen am C-Terminus des Knob der Fiber präsentiert
werden. Es ist denkbar, dass "Einschränkung" gemäß der vorliegenden
Erfindung die Affinität
erhöht,
weil sie das Molekül
in eine topologische Konformation bringt, in der es in Synchronisation
mit seinem Rezeptor ist, und auf diese Weise die Bindung erleichtert.
Jedoch ist die Beschreibung nicht auf einen besonderen Wirkmechanismus
beschränkt
und ist nicht so auszulegen.
-
Mit
Bezug auf die Schleifendomänen
des Fiber-Knob, welche im Kontext der Erfindung verwendet werden
können,
ist die Kristallstruktur des Fiber-Knob beschrieben worden (siehe
z. B. Xia et al., supra, insbesondere 4). Das
Knob-Monomer umfasst eine achtsträngige antiparallele β-Sandwich-Faltung.
Die Gesamtstruktur des Fiber-Knob-Trimers ähnelt einem dreiflügeligen
Propeller, wobei bestimmte β-Stränge von
jedem der drei Monomere die Flächen
der Flügel
bilden. Insbesondere scheinen die folgenden Reste des Ad5-Fiber-Knob wichtig für die Wasserstoffbindung
in dem β-Sandwich-Motiv:
400–402,
419–428,
431–440,
454–461, 479–482, 485–486, 516–521, 529–536, 550–557 und
573–578.
Die verbleibenden Reste des Proteins (die nicht kritisch zu sein
scheinen für
die Bildung der Fiberprotein-Sekundärstruktur) definieren die ex ponierten Schleifen
der Protein-Knob-Domäne.
Insbesondere umfassen die Reste inklusive 403–418 die AB-Schleife, die Reste
inklusive 441–453
umfassen die CD-Schleife, die Reste inklusive 487–514 umfassen
die DG-Schleife, die Reste inklusive 522–528 umfassen die GH-Schleife,
die Reste inklusive 537–549
umfassen die HI-Schleife und die Reste inklusive 558–572 umfassen
die IJ-Schleife.
-
Gemäß vorliegender
Erfindung ist "Schleife" in dem generischen
Sinne gemeint, dass sie eine Spanne von Aminosäureresten definiert (d. h.
mehr als eine, vorzugsweise weniger als 200 und noch mehr bevorzugt weniger
als 30), welche mit der nicht-nativen Aminosäuresequenz substituiert werden
können,
um ein Peptidmotiv zu umfassen, welches Zell-Targeting erlaubt.
Während
derartige Schleifen hierin mit Bezug auf die Ad5-Sequenz definiert
sind, ist das Sequenz-Alignment anderer Fiber-Spezies beschrieben
worden (siehe z. B. Xia et al., supra). Für diese anderen Spezies (insbesondere
Ad2, Ad3, Ad7, Ad40 und Ad41, beschrieben von Xia et al., supra)
scheinen die korrespondierenden Schleifenregionen der Knob-Domänen vergleichbar
zu sein.
-
Ferner
scheinen die korrespondierenden Reste, welche in dem Fiber-Knob
für die
Proteinbindung/-faltung wichtig sind, zwischen Fiberproteinen unterschiedlicher
adenoviraler Serotypen konserviert zu sein (Xia et al., supra).
Dies legt nahe, dass auch für
diejenigen adenoviralen Spezies, bei denen die Kristallstruktur
des Fiberproteins nicht bekannt ist, außerhalb dieser konservierten
Reste nicht-konservierte Regionen oder Regionen, welche nicht den
hohen Grad an Konservierung zeigen, der für die Reste beobachtet wird,
welche für die
Proteinfunktionalität
kritisch sind, liegen werden. Wahrscheinlich wird die Sequenz des
Fiber-Knob-Proteins in diesen nicht-konservierten Regionen als eine
Schleife präsent
sein infolge der Abwesenheit von wichtigen intramolekularen Interaktionen
in dieser Region des Proteins. Die Schleifensequenzen, welche diese nicht-konservierten
Regionen umfassen, können ähnlich mutiert
werden wie hierin beschrieben durch Inkorporation von Peptidmotiven,
welche Zell-Targeting erlauben. Diese sogenannten nicht-konservierten
Sequenzen umfassen wahrscheinlich jegliche Aminosäuren, welche
außerhalb
der konservierten Regionen vorkommen (d. h. die Reste nicht-inklusive
derjenigen, wel che zu den Ad5-Resten 400–402, 419–428, 431–440, 454–461, 479–482, 485–486, 516–521, 529–536, 550–557 und 573–578 korrespondieren).
-
Allgemeiner
werden die nicht-konservierten Regionen hydrophobe Reste umfassen,
welche typischerweise im Inneren eines Proteins gefunden werden.
Derartige hydrophobe Reste umfassen, sind aber nicht beschränkt auf
Ile, Val, Leu, Trp, Cys und Phe. Demgegenüber werden die konservierten
Regionen allgemein hydrophile Reste umfassen, z. B. geladene Reste
(z. B. Arg, Lys, Glu, Asp und dergleichen) oder polare Reste oder
Reste, welche eine Hydroxyl-Gruppe
umfassen (z. B. Thr, Ser, Asn, Gln etc.). Dies bedeutet, dass eine grobe
Approximation für
die exponierten und verdeckten Aminosäuren des Fiberproteins abgeleitet
werden kann auf Basis seines Hydrophobizitäts-/Hydrophilizitäts-Diagramms.
-
Die
vorliegende Erfindung stellt also ein chimäres Adenovirus-Fiberprotein
bereit, welches eine eingeschränkte
nicht-native Aminosäuresequenz
umfasst. Vorzugsweise ist die nicht-native Aminosäuresequenz eingeschränkt durch
ihre Anwesenheit in einer Schleife des Knob des chimären Fiberproteins.
Insbesondere ist die nicht-native Aminosäuresequenz wünschenswerterweise
in eine oder an Stelle einer Proteinsequenz in einer Schleife des
Knob des chimären
adenoviralen Fiberproteins inseriert. Optional ist die Fiberprotein-Schleife
ausgewählt
aus der Gruppe, welche aus den AB-, CD-, DG-, GH-, und IJ-Schleifen
besteht und ist wünschenswerterweise
die HI-Schleife. Ferner umfasst die Schleife vorzugsweise Aminosäurereste
in dem Fiber-Knob, welche von den Ad5-Resten 400–402, 419–428, 431–440, 454–461, 479–482, 485–486, 516–521, 529–536, 550–557 und 573–578 verschieden
sind. Wünschenswerterweise
umfasst die Schleife Aminosäurereste,
welche aus der Gruppe ausgewählt
sind, die aus den Resten 403–418,
441–453,
487–514,
522–528, 537–549 und
558–572
besteht.
-
Insbesondere
ist es bevorzugt, wenn die in der Schleife präsente nicht-native Aminosäuresequenz eine
Sequenz umfasst, die ausgewählt
ist aus der Gruppe, welche besteht aus: SEQ ID NO:1, SEQ ID NO:2, SEQ
ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:17, SEQ ID NO:19, SEQ
ID NO:23, SEQ ID NO:31, SEQ ID NO:35, SEQ ID NO:39, SEQ ID NO:43,
SEQ ID NO:49, SEQ ID NO:53, SEQ ID NO:56, SEQ ID NO:59 und SEQ ID
NO:63, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:79, und
wobei die Sequenz entweder am C- oder am N-Terminus um 1, 2 oder
3 Reste deletiert sein kann. Die nicht-native Aminosäuresequenz kann ferner wünschenswerterweise
konservative Aminosäuresubstitutionen
dieser Sequenzen umfassen, wie hierin weiter beschrieben. Optional
können
diese Sequenzen in dem chimären
Protein präsent sein,
wie z. B. in 4, 5, 6, 8, 9 und 10 gezeigt.
-
Die
Erfindung stellt ferner ein Mittel bereit zum Targeting von Adenovirus,
wobei die Peptidmotive in einer eingeschränkten Umgebung am C-Terminus
des Fiberproteins in der Region des Fiber-Knob präsentiert werden.
Dieses Verfahren umfasst die Generierung von Schleifen (d. h. "nicht präexistierenden
Schleifen") durch
Bindung zwischen Cystein-Resten, um dadurch eine schleifenähnliche
Sekundärstruktur
in der Domäne des
Proteins zu erzeugen, in welche das Peptidmotiv inseriert wird.
Allgemein wird erfindungsgemäß die hinzugefügte nicht-native
Aminosäuresequenz
selbst eine schleifenähnliche
Struktur bilden (durch Disulfidbindung zwischen Cystein-Resten,
welche in vivo vorkommen). Es ist jedoch auch möglich, dass die Schleife gebildet
wird infolge Bindung zwischen einem Cystein-Rest, welcher in der
nicht-nativen Aminosäuresequenz präsent ist,
und einem Cystein-Rest in dem Wildtyp-Fiberprotein. In diesem Sinne
ist die Schleifenbildung der Sequenz nicht inhärent, aber potentiell.
-
Insbesondere
umfasst ein chimäres
Adenovirus-Fiberprotein gemäß der Erfindung
eine nicht-native Aminosäuresequenz,
welche durch ihren Besitz eines RGD-Peptids (oder eines anderen ähnlichen
Peptids, z. B. LDV, wie hierin beschrieben) und eines oder mehrerer
Cystein-Paare eingeschränkt
ist. Gemäß vorliegender
Erfindung umfasst ein "Paar" zwei Cysteine, welche
durch mindestens eine intervenierende Aminosäure getrennt sind. Wenn die
Sequenz nur ein einziges Paar umfasst, sind die Cysteine wünschenswerterweise durch
die RGD-Sequenz (oder eine andere ähnliche Sequenz, welche verwendet
werden kann, um Zell-Targeting zu bewirken, und die vorzugsweise
weniger als 30 Aminosäuren
umfasst) getrennt, derart, dass die nicht-präexistierende Schleife erzeugt
werden kann, d. h. durch Disulfidbindung. Vorzugsweise sind die
Cystein-Reste in diesem Falle durch weniger als 30 Aminosäuren getrennt,
z. B. durch eine Mischung von Glycin- und Serin-Resten wie in [SEQ
ID NO:72]. Unabhängig
davon, welche nicht-native Aminosäuresequenz verwendet wird:
sie muss eine schleifenartige Sekundärstruktur umfassen.
-
Mit
Bezug auf diese nicht-präexistierende
Schleife sind ein potentielles Peptidmotiv und Variationen desselben
hierin beschrieben worden. Jedoch sind andere RGD-haltige cyclische
Peptide in der Literatur beschrieben worden und können im
Kontext der Erfindung als die nicht-native Aminosäurensequenz
Verwendung finden (siehe z. B. Koivunen et al., Bio/Technology,
13, 265–270
(1995)). Insbesondere kann eine weitere nicht-native Aminosäuresequenz
gemäß der Erfindung
die Sequenz CDCRGDCFC (d. h. Cys Asp Cys Arg Gly Asp Cys Phe Cys
[SEQ ID NO:3]) umfassen. Die nicht-native Aminosäuresequenz umfasst jedoch vorzugsweise
Cys Xaa Cys Arg Gly Asp Cys Xaa Cys [SEQ ID NO:4] (worin "Xaa" eine beliebige Nucleinsäure ist)
oder Cys (Xaa)A Cys Arg Gly Asp Cys (Xaa)B Cys [SEQ ID NO:5], worin "A" und "B" unabhängig voneinander
variieren können
und eine beliebige Zahl von 0 bis 8 sein können, solange entweder A oder
B 1 ist. Insbesondere umfasst die nicht-native Aminosäuresequenz
vorzugsweise die Sequenz Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Cys
Arg Gly Asp Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Cys [SEQ ID NO:5],
wobei Deletionen von Aminosäureresten,
welche von Cystein verschieden sind, auf einer oder beiden Seiten
der RGD-(d. h. Arg Gly Asp-)Sequenz von 1, 2, 3, 4, 5, 6, 7 oder
8 Resten erzeugt werden können.
-
Wünschenswerterweise
wird also die nicht-native Aminosäuresequenz, welche die nicht-präexistierende
Schleife umfasst, in eine oder an Stelle einer Proteinsequenz am
C-Terminus des chimären
Adenovirus-Fiberproteins inseriert. Vorzugsweise wird die nicht-native
Aminosäuresequenz,
welche die nicht-präexistierende
Schleife umfasst, in eine Schleife des Knob des chimären adenoviralen
Fiberproteins inseriert. Optimalerweise umfasst die nicht-native
Aminosäuresequenz
eine Sequenz, ausgewählt
aus der Gruppe, welche aus SEQ ID NO:3, SEQ ID NO:4 und SEQ ID NO:5
besteht, wobei die Sequenz entweder am C- oder am N-Terminus um
1, 2 oder 3 Reste deletiert sein kann. Die Aminosäuresequenz
kann ferner wünschenswerterweise
konservative Aminosäuresubstitute
dieser Sequenzen umfassen, wie hierin weiter beschrieben.
-
Optional
ist die nicht-präexistierende
Schleife an den C-Terminus des Fiberproteins oder in einer Fiber-Knob-Schleife
mittels einer sogenannten "Spacer"-Sequenz angeheftet. Die Spacer-Sequenz
kann einen Teil der nicht-nativen Aminosäuresequenz selbst umfassen
oder eine völlig
separate Sequenz sein. Insbesondere ist eine Spacer-Sequenz eine
Sequenz, welche vorzugsweise zwischen der nativen Proteinsequenz
und der nicht-nativen Sequenz, zwischen einer nicht-nativen Sequenz
und einer weiteren nicht-nativen Sequenz oder zwischen einer nativen
Sequenz und einer weiteren nativen Sequenz interveniert. Wünschenswerterweise
ist eine derartige Sequenz in das Protein inkorporiert, um zu gewährleisten,
dass die nicht-native Sequenz, welche das Epitop für einen
Antikörper
oder eine Zelloberflächen-Bindungsstelle
umfasst, von der dreidimensionalen Struktur der chimären Fiber
derart hervorragt, dass sie mit Zellen interagieren und an dieselben
binden kann. Eine Spacer-Sequenz kann eine beliebige geeignete Länge aufweisen,
vorzugsweise von ca. 3 bis ca. 30 Aminosäuren, und umfasst beliebige
Aminosäuren,
z. B. eine Mischung von Glycin- und Serin-Resten wie in [SEQ ID
NO:72]. Optimalerweise interferiert die Spacer-Sequenz nicht mit
der Funktion des Fiberproteins.
-
Nucleinsäure codierend für ein chimäres Adenovirus-Fiberprotein
-
Wie
bereits angegeben, wird die nicht-native Aminosäuresequenz vorzugsweise auf
der DNA-Ebene eingeführt.
Demgemäß stellt
die Erfindung ferner eine isolierte und gereinigte Nucleinsäure bereit,
welche ein chimäres
Adenovirus-Fiberprotein codiert, welches eine eingeschränkte nicht-native
Aminosäuresequenz
gemäß der Erfindung
umfasst. Wünschenswerterweise
umfasst die Nucleinsäuresequenz,
welche die nicht-native Aminosäuresequenz
codiert, eine Sequenz, die ausgewählt ist aus der Gruppe, welche
besteht aus: SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:22, SEQ ID NO:26,
SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:34, SEQ ID NO:38, SEQ ID NO:42,
SEQ ID NO:48, SEQ ID NO:52, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58 und
SEQ ID NO:62, sowie konservativ modifizierte Varianten dieser Nucleinsäuresequenzen.
-
Eine "konservativ modifizierte
Variante" ist eine
Variation der Nucleinsäuresequenz,
die in einer konservativen Aminosäuresubstitution resultiert.
Eine "konservative
Aminosäuresubstitution" ist eine Aminosäure, welche
mit einer alter nativen Aminosäure ähnlicher
Ladungsdichte, Hydrophilizität/Hydrophobizität, Größe und/oder
Konfiguration substituiert ist (z. B. Val für Ile). Im Vergleich dazu ist
eine "nicht-konservativ
modifizierte Variante" eine
Variation der Nucleinsäuresequenz,
die in einer nicht-konservativen Aminosäuresubstitution resultiert.
Eine "nicht-konservative
Aminosäuresubstitution" ist eine Aminosäure, welche
mit einer alternativen Aminosäure
verschiedener Ladungsdichte, Hydrophilizität/Hydrophobizität, Größe und/oder
Konfiguration substituiert ist (z. B. Val für Phe). Die Mittel zur Herstellung
derartiger Modifikationen sind auf dem Fachgebiet wohlbekannt, sie
sind in den folgenden Beispielen beschrieben und können ferner
mittels kommerziell erhältlicher
Kits und Vektoren erreicht werden (z. B. New England Biolabs, Inc.,
Beverly, MA; Clontech, Palo Alto, CA). Ferner sind die Mittel zum
Abschätzen
derartiger Substitutionen (z. B. hinsichtlich des Effekts auf die
Fähigkeit,
an Zellen zu binden und in diese einzutreten) in den hierin vorgestellten
Beispielen beschrieben. Ferner sind weitere, im Stand der Technik
beschriebene Ansätze
verfügbar
zum Identifizieren von Peptidsequenzen, welche als Liganden für einen
Zelloberflächenrezeptor
fungieren und somit für
die vorliegende Erfindung Verwendung finden können (siehe z. B. Russell,
Nature Medicine, 2, 276–277
(1996)).
-
Die
Mittel zur Herstellung eines derartigen chimären Fiberproteins, insbesondere
die Mittel zum Einführen
der Sequenz auf der DNA-Ebene, sind auf dem Fachgebiet wohlbekannt
und in den folgenden Beispielen beschrieben. Kurz gefasst umfasst
das Verfahren die Einführung
einer Sequenz in die das Fiberprotein codierende Sequenz, um so
ein neues Peptidmotiv in eine oder an Stelle einer Proteinsequenz
am C-Terminus des Wildtyp-Fiberproteins oder in eine Schleife eines
Knob des Wildtyp-Fiberproteins zu inserieren. Eine derartige Einführung kann
in der Insertion eines neuen Peptidbindungsmotivs resultieren oder
in der Erzeugung eines Peptidmotivs (wobei z. B. ein Teil der das
Motiv umfassenden Sequenz bereits in dem nativen Fiberprotein präsent ist).
Das Verfahren kann ferner durchgeführt werden, um Fiber-Sequenzen
mit einer nicht-nativen Aminosäuresequenz
gemäß der Erfindung
zu ersetzen.
-
Allgemein
kann dies erreicht werden durch Klonieren der das chimäre Fiberprotein
codierenden Nucleinsäuresequenz
in ein Plasmid oder einen anderen Vektor für leichte Manipulation der
Sequenz. Sodann wird eine singuläre
Re striktionsstelle, an der weitere Sequenzen in das Fiberprotein
eingefügt
werden können, identifiziert
oder in die Fiber-Sequenz inseriert. Ein doppelsträngiges synthetisches
Oligonucleotid wird allgemein aus überlappenden synthetischen
einzelsträngigen
Sense- und Antisense-Oligonucleotiden erzeugt, derart, dass das
doppelsträngige
Oligonucleotid die Restriktionsstellen, welche die Zielsequenz flankieren,
inkorporiert und z. B. zur Inkorporation von Austausch-DNA verwendet werden
kann. Das Plasmid oder der andere Vektor wird mit dem Restriktionsenzym
gespalten, und die Oligonucleotid-Sequenz mit kompatiblen kohäsiven Enden
wird in das Plasmid oder den anderen Vektor ligiert, um die Wildtyp-DNA
zu ersetzen. Andere Mittel zur ortsgerichteten in-vitro-Mutagenese, wie sie
z. B. dem Fachmann bekannt sind und (insbesondere durch PCR) z.
B. mittels kommerziell erhältlicher
Kits erreicht werden können,
können
ebenfalls Verwendung finden, um die mutierte Sequenz in die Fiberprotein-Codierungssequenz
einzuführen.
-
Ist
die mutierte Sequenz einmal in das chimäre Coat-Protein eingeführt, so
kann das die Sequenz codierende Nucleinsäurefragment isoliert werden,
z. B. durch PCR-Amplifizierung mittels 5'- und 3'-Primer, vorzugsweise solchen, welche
in weiteren singulären
Restriktionsstellen terminieren. Die Verwendung von Primer auf diese
Art und Weise resultiert in einem amplifizierten, chimäre Fiber
enthaltenden Fragment, welches von den singulären Restriktionsstellen flankiert
ist. Die singulären
Restriktionsstellen können
für weiteres
günstiges Subklonieren
des Fragments verwendet werden. Es können auch andere Mittel zum
Generieren eines chimären
Fiberproteins verwendet werden. Diese Verfahren sind dem Fachmann
hoch vertraut.
-
Vektor umfassend ein chimäres Adenovirus-Fiberprotein
-
Ein "Vektor" gemäß der Erfindung
ist ein Vehikel für
den Gentransfer, wie dieser Terminus vom Fachmann verstanden wird.
Drei Typen von Vektoren, welche von der Erfindung umfasst sind,
sind: Plasmide, Phagen und Viren. Plasmide, Phagen und Viren können in
ihrer Nucleinsäureform
in eine Zelle transferiert werden (z. B. via Transfektion). Im Vergleich
dazu können
Phagen und Viren auch mit der Nucleinsäure in einer "Kapsel"-Form transferiert
werden. Somit werden die Vektoren (z. B. in Kapselform), welche
zum Gentransfer ver wendet werden können, hierin allgemein als "Vektoren" bezeichnet, wobei
Nucleinsäureformen
im Besonderen als "Transfervektoren" bezeichnet werden.
Jedoch sind Transfervektoren ebenfalls Vektoren im Kontext der Erfindung.
-
Vorzugsweise
ist ein Vektor gemäß der Erfindung
ein Virus, speziell ein Virus, welches ausgewählt ist aus der Gruppe, die
aus unbehüllten
Viren, d. h. unbehülltes
RNA- oder DNA-Viren, besteht. Ferner kann ein Virus ausgewählt sein
aus der Gruppe, welche aus behüllten
Viren besteht, d. h. behüllten
RNA- oder DNA-Viren. Derartige Viren umfassen vorzugsweise ein Fiberprotein
oder ein analoges Coat-Protein, welches zum Zelleintritt verwendet
wird. Wünschenswerterweise
ist das virale Coat-Protein ein Protein, welches von dem Kapsid
nach außen
vorsteht, derart, dass es mit Zellen interagieren kann. Im Falle
von behüllten
RNA- oder DNA-Viren ist das Coat-Protein vorzugsweise ein Lipid-Hüllglycoprotein
(d. h. ein sogenanntes "Spike" oder Peplomer).
-
Insbesondere
ist ein Vektor vorzugsweise ein unbehülltes Virus (d. h. entweder
ein RNA- oder ein DNA-Virus) aus der Familie Hepadnaviridae, Parvoviridae,
Papovaviridae, Adenoviridae oder Picornaviridae. Ein bevorzugtes
unbehülltes
Virus gemäß der Erfindung
ist ein Virus der Familie Hepadnaviridae, speziell des Genus Hepadnavirus.
Ein Virus der Familie Parvoviridae ist wünschenswerterweise vom Genus
Parvovirus (z. B. Parvoviren von Säugetieren und Vögeln) oder
Dependovirus (z. B. Adeno-assoziierte Viren (AAVs)). Ein Virus der
Familie Papovaviridae entstammt vorzugsweise der Subfamilie Papillomavirinae
(z. B. die Papillomaviren, einschließlich, aber nicht beschränkt auf
humane Papillomaviren (HPV) 1–48)
oder der Subfamilie Polyomavirinae (z. B. die Polyomaviren, einschließlich, aber
nicht beschränkt
auf JC-, SV40- und BK-Virus). Ein Virus der Familie Adenoviridae
ist wünschenswerterweise
vom Genus Mastadenovirus (z. B. Säuger-Adenoviren) oder Aviadenovirus
(z. B. Vogel-Adenoviren).
Ein Virus der Familie Picornaviridae ist vorzugsweise ein Hepatitis-A-Virus
(HAV), ein Hepatitis-B-Virus (HBV) oder ein Nicht-A- oder Nicht-B-Hepatitis-Virus.
-
Ähnlich kann
ein Vektor ein behülltes
Virus aus der Familie Herpesviridae oder Retroviridae sein, oder er
kann ein Sindbis-Virus sein. Ein bevorzugtes behülltes Virus gemäß der Erfindung
ist ein Virus der Familie Herpesviridae, spe ziell der Subfamilie
oder des Genus Alphaherpesvirinae (z. B. Herpes-simplex-artige Viren), Simplexvirus
(z. B. Herpex-simplex-artige Viren), Varicellavirus (z. B. Varicella-
und Pseudowut-artige Viren), Betaherpesvirinae (z. B. die Cytomegaloviren),
Cytomegalovirus (z. B. die humanen Cytomegaloviren), Gammaherpesvirinae
(z. B. die Lymphocyten-assoziierten Viren) und Lymphocryptovirus
(z. B. EB-artige Viren).
-
Ein
weiteres bevorzugtes behülltes
Virus ist ein RNA-Virus aus der Familie Retroviridae (d. h. ein
Retrovirus), insbesondere ein Virus des Genus oder der Subfamilie
Oncovirinae, Spumavirinae, Spumavirus, Lentivirinae oder Lentivirus.
Ein RNA-Virus aus der Subfamilie Oncovirinae ist wünschenswerterweise
ein humanes T-lymphotropes Virus Typ 1 oder 2 (d. h. HTLV-1 oder
HTLV-2) oder bovines Leukämie-Virus
(BLV), ein aviäres
Leukose-Sarkom-Virus (z. B. Rous-Sarkom-Virus (RSV), aviäres Myeloblastose-Virus
(AMV), aviäres Erythroblastose-Virus
(AEV), Rous-assoziiertes Virus (RAV)-1 bis 50, RAV-0), ein C-Typ-Virus
von Säugetieren (z.
B. Moloney-Maus-Leukämie-Virus
(MuLV), Harvey-Maus-Sarkom-Virus (HaMSV), Abelson-Maus-Leukämie-Virus
(A-MuLV), AKR-MuLV, felines Leukämie-Virus
(FeLV), Simian-Sarkom-Virus, Reticuloendotheliose-Virus (REV), Milznekrose-Virus
(SNV)), ein B-Typ-Virus (z. B. Maus-Mammatumor-Virus (MMTV)) oder
ein D-Typ-Virus (z. B. Mason-Pfizer-Affen-Virus
(MPMV), "SAIDS"-Viren). Ein RNA-Virus
der Subfamilie Lentivirus ist wünschenswerterweise
ein humanes Immundefizienz-Virus Typ 1 oder 2 (d. h. HIV-1 oder
HIV-2, wobei HIV-1 früher
Lymphadenopathie-assoziiertes Virus 3 (HTLV-III) und "Acquired-Immune-Deficiency-Syndrome-(AIDS)-related-Virus" (ARV) genannt wurde),
oder ein anderes, zu HIV-1 oder HIV-2 verwandtes Virus, welches
identifiziert und mit AIDS- oder AIDS-artiger Erkrankung assoziiert
ist. Das Akronym "HIV" oder die Ausdrücke "AIDS-Virus" oder "humanes Immundefizienz-Virus" werden hierin in
dem Sinne verwendet, dass sie sich generisch auf diese HIV-Viren
und HIV-verwandte und -assoziierte Viren beziehen. Ferner ist ein
RNA-Virus der Subfamilie Lentivirus vorzugsweise ein Visna/Maedi-Virus
(das z. B. Schafe infiziert), ein felines Immundefizienz-Virus (FIV),
bovines Lentivirus, Simian-Immunodefizienz-Virus (SIV), ein equines
infektiöses
Anämie-Virus
(EIAV) oder ein caprines Arthritis-Encephalitis-Virus (CAEV).
-
Ein
besonders bevorzugter Vektor gemäß der Erfindung
ist ein adenoviraler Vektor (d. h. ein viraler Vektor aus der Familie
Adenoviridae, optimalerweise vom Genus Mastadenovirus). Wünschenswerterweise
ist ein derartiger Vektor ein Ad2- oder Ad5-Vektor, wobei jedoch
auch adenovirale Vektoren anderen Serotyps verwendet werden können. Adenovirale
Stocks, welche gemäß der Erfindung
Verwendung finden können,
umfassen einen beliebigen der Adenovirus-Serotypen 1 bis 47, die
derzeit von American Type Culture Collection (ATCC, Rockville, MD)
verfügbar
sind, oder einen beliebigen anderen, von einer beliebigen anderen
Quelle erhältlichen
Adenovirus-Serotyp. Beispielsweise kann ein Adenovirus von einem
Serotyp der Untergruppe A (z. B. Serotypen 12, 18, 31), der Untergruppe
B (z. B. Serotypen 3, 7, 11, 14, 16, 21, 34, 35), der Untergruppe
C (z. B. Serotypen 1, 2, 5, 6), der Untergruppe D (z. B. Serotypen
8, 9, 10, 13, 15, 17, 19, 20, 22–30, 32, 33, 36–39, 42–47), der
Untergruppe E (Serotyp 4), der Untergruppe F (Serotyp 40, 41) oder
von einem beliebigen anderen adenoviralen Serotyp sein.
-
Der
zum Gentransfer verwendete adenovirale Vektor kann wildtypisch (d.
h. replikationskompetent) sein. Alternativ kann der adenovirale
Vektor genetisches Material umfassen mit mindestens einer Modifikation darin,
welche das Virus replikationsdefizient machen kann. Die Modifikation
des adenoviralen Genoms kann umfassen, ist aber nicht beschränkt auf:
Hinzufügung
eines DNA-Segments, "Rearrangement" eines DNA-Segmentes,
Deletion eines DNA-Segments,
Austausch eines DNA-Segments oder Einführung einer DNA-Läsion. Ein
DNA-Segment kann so klein sein wie ein Nucleotid und so groß wie 36
Kilobasenpaare (d. h. die ungefähre
Größe des adenoviralen
Genoms) oder, alternativ, gleich der maximalen Menge, welche in
ein adenovirales Virion verpackt werden kann (d. h. ca. 38 kb).
Bevorzugte Modifikationen des adenoviralen Genoms umfassen Modifikationen
in der E1-, E2-, E3- und/oder E4-Region. Ein adenoviraler Vektor
kann ferner bevorzugt ein Cointegrat sein, d. h. eine Ligation von
adenoviralen genomischen Sequenzen mit anderen Sequenzen, z. B.
anderen Virus-, Phagen- oder Plasmidsequenzen.
-
Mit
Bezug auf einen viralen Vektor (z. B. insbesondere einen replikationsdefizienten
adenoviralen Vektor) kann ein derartiger Vektor entweder vollständige Kapside
(d. h. umfassend ein virales Genom, z. B. ein adenovirales Genom) oder
leere Kapside (d. h. worin ein virales Genom fehlt oder degradiert
ist, z. B. durch physikalische oder chemische Mittel) umfassen.
Vorzugsweise umfasst der virale Vektor vollständige Kapside. Nach den gleichen
Grundsätzen – da Verfahren
zum Transferieren von Viren, Plasmiden und Phagen in Form ihrer
Nucleinsäuresequenzen
(d. h. RNA oder DNA) zur Verfügung
stehen – kann ähnlicherweise
ein Vektor (d. h. ein Transfervektor) RNA oder DNA in der Abwesenheit
jeglichen assoziierten Proteins wie Kapsidprotein und in der Abwesenheit
jeglichen Hülllipids
umfassen. Während
also erfindungsgemäß ein Vektor
ein chimäres adenovirales
Fiberprotein "umfasst", umfasst ein Transfervektor
ein chimäres
adenovirales Fiberprotein in dem Sinne, dass er das chimäre adenovirale
Fiberprotein "codiert".
-
Ein
erfindungsgemäßer Vektor
kann zusätzliche
Sequenzen und Mutationen umfassen, z. B. einige innerhalb des Fiberproteins
selbst. Beispielsweise umfasst ein erfindungsgemäßer Vektor ferner vorzugsweise eine
Nucleinsäure,
welche ein Passagiergen umfasst.
-
Eine "Nucleinsäure" ist ein Polynucleotid
(DNA oder RNA). Ein "Gen" ist eine Nucleinsäuresequenz, welche
für ein
Protein oder ein naszierendes RNA-Molekül codiert. Ein "Passagiergen" ist ein Gen, welches
in einem Vektor (z. B. einem Transfervektor) gemäß der Erfindung nicht typischerweise
präsent
ist und in diesen subkloniert ist und welches nach Einführung in
eine Wirtszelle von einer erkennbaren Änderung in der intrazellulären Umgebung
begleitet ist (z. B. von einem erhöhten Level an Desoxyribonucleinsäure (DNA),
Ribonucleinsäure
(RNA), Peptid oder Protein oder von einer veränderten Produktions- oder Degradationsrate
derselben). Ein "Genprodukt" ist entweder ein
bisher untranslatiertes RNA-Molekül, transkribiert aus einem
gegebenen Gen oder einer Codierungssequenz (z. B. mRNA oder Antisense-RNA),
oder die Polypeptidkette (d. h. Protein oder Peptid), translatiert
aus dem von dem gegebenen Gen oder der Codierungssequenz transkribierten
mRNA-Molekül.
Während
ein Gen Codierungssequenzen plus jegliche nicht-codierende Sequenzen
umfasst, umfasst eine "Codierungssequenz" keine nicht-codierende
(d. h. regulatorische) DNA. Ein Gen oder eine Codierungssequenz
ist "rekombinant", wenn die Basensequenz
entlang dem Molekül
verändert
worden ist gegenüber
der Sequenz, in der das Gen oder die Codierungssequenz typischerweise
in der Natur gefunden wird, oder wenn die Basensequenz nicht typischerweise
in der Natur gefunden wird. Gemäß vorliegender
Erfindung kann ein Gen oder eine Codierungssequenz ganz oder teilweise
synthetisch hergestellt sein, genomische oder komplementäre DNA-(cDNA-)Sequenzen
umfassen und in der Form von entweder DNA oder RNA bereitgestellt
sein.
-
Nicht-codierende
Sequenzen oder regulatorische Sequenzen umfassen Promotor-Sequenzen.
Ein "Promotor" ist eine DNA-Sequenz,
welche die Bindung von RNA-Polymerase dirigiert und dadurch RNA-Synthese
fördert. "Enhancer" sind cis-agierende
Elemente von DNA, welche die Transkription benachbarter Gene stimulieren
oder inhibieren. Ein Enhancer, der die Transkription inhibiert,
wird auch "Silencer" genannt. Enhancer
unterscheiden sich von DNA-Bindungsstellen für sequenzspezifische DNA-Bindungsproteine,
welche nur in dem Promotor gefunden werden (auch "Promotor-Elemente" genannt), insofern,
als Enhancer in beiden Ausrichtungen funktionieren können und über Distanzen
von bis zu einigen Kilobasenpaaren, auch von einer Position stromabwärts einer
transkribierten Region aus. Erfindungsgemäß ist eine Codierungssequenz "operativ verknüpft" mit einem Promotor
(z. B. wenn sowohl die Codierungssequenz als auch der Promotor ein
Passagiergen konstituieren), wenn der Promotor in der Lage ist,
Transkription dieser Codierungssequenz zu dirigieren.
-
Demgemäß kann ein "Passagiergen" ein beliebiges Gen
sein und ist wünschenswerterweise
entweder ein therapeutisches Gen oder ein Reporter-Gen. Vorzugsweise
ist ein Passagiergen in der Lage, in einer Zelle exprimiert zu werden,
in die der Vektor internalisiert worden ist. Beispielsweise kann
das Passagiergen ein Reportergen umfassen oder eine Nucleinsäuresequenz,
welche ein Protein codiert, das in irgendeiner Weise in einer Zelle
detektiert werden kann. Das Passagiergen kann ferner ein therapeutisches
Gen umfassen, z. B. ein therapeutisches Gen, das seinen Effekt auf
RNA- oder Proteinebene ausübt.
Beispielsweise kann ein Protein, welches von einem transferierten
therapeutischen Gen codiert wird, bei der Behandlung einer Erbkrankheit
eingesetzt werden, so z. B. die Cystische-Fibrose-Transmembran-Leitfähigkeitsregulator-cDNA
für die
Behandlung der cystischen Fibrose. Das von dem therapeutischen Gen
codierte Protein kann seinen therapeutischen Effekt dadurch ausüben, dass
es in Zelltötung
resultiert. So kann z. B. die Expression des Gens selbst zu Zelltötung führen, wie
z. B. bei der Expression des Diphterietoxin-A-Gens, oder die Expression
des Gens kann Zellen selektiv sensitiv für die Abtötungswirkung gewisser Arzneimittel
machen; so macht z. B. die Expression des HSV-Thymidinkinase-Gens
Zellen sensitiv für
antivirale Verbindungen, einschließlich Acyclovir, Gancyclovir
und FIAU (1-(2-Desoxy-2-fluoro-β-D-arabinofuranosil)-5-iodouracil).
-
Ferner
kann das therapeutische Gen seinen Effekt auf der RNA-Ebene ausüben, z.
B. durch Codieren einer "Antisense-Message" oder eines Ribozyms,
eines Proteins, das das Spleißen
oder die 3'-Prozessierung (z.
B. Polyadenylierung) beeinflusst, oder es kann ein Protein codieren,
welches durch Beeinflussung des Expressionslevels eines anderen
Gens innerhalb der Zelle wirkt (d. h. wobei Genexpression breit,
als alle Schritte von der Transkriptionsinitiation bis zur Produktion
eines prozessierten Proteins umfassend betrachtet wird), eventuell
u. a. durch Vermittlung einer veränderten mRNA-Akkumulationsrate,
einer Veränderung
des mRNA-Transports und/oder einer Veränderung in der posttranskriptionalen
Regulation. Demgemäß ist es
beabsichtigt, dass die Verwendung des Ausdrucks "therapeutisches Gen" diese und jegliche andere Ausführungsformen
dessen umfasst, was allgemeiner als Gentherapie bezeichnet wird,
wie dem Fachmann bekannt. Ähnlich
kann das rekombinante Adenovirus zur Gentherapie oder zum Studium
der Expressionseffekte des Gens in einer gegebenen Zelle oder einem
Gewebe in vitro oder in vivo verwendet werden.
-
Demgemäß stellt
die vorliegende Erfindung einen Vektor bereit, umfassend ein chimäres Adenovirus-Fiberprotein,
welches eine eingeschränkte
nicht-native Aminosäuresequenz
umfasst. Ein derartiger Vektor umfasst vorzugsweise ein Passagiergen,
welches optional entweder in das adenovirale Genom inseriert oder an
ein Coat-Protein (z. B. Pentonbasis-, Fiber- oder Hexon-Protein)
des Adenovirus mittels einer Protein/DNA-Interaktion angeheftet
ist. Alternativ trägt
der adenovirale Vektor vorzugsweise eine unverknüpfte DNA oder ein Proteinmolekül oder einen
anderen kleinen Rest in eine Zelle mittels Adenovirus-"Bystander"-vermittelter Aufnahme
dieser Moleküle
(Internationale Patentanmeldung
WO
95/21259 ).
-
Nach
diesen Grundsätzen
kann das erfindungsgemäße Verfahren
verwendet werden zum Transferieren von Nucleinsäuresequenzen, welche als Teil
des adenoviralen Genoms transportiert werden (d. h. codiert durch
Adenovirus), und zum Transferieren von Nucleinsäuresequenzen, welche an die
Außenseite
des adenoviralen Kapsids angeheftet sind (Curie) et al., supra),
sowie unangehefteter DNA, Protein oder anderen kleinen Molekülen, welche ähnlich durch
adenovirale "Bystander"-vermittelte Aufnahme
transportiert werden können
(Internationale Patentanmeldung
WO
95/21259 ). Das Verfahren kann verwendet werden zur Vermittlung von
Gen- und/oder Protein-Delivery entweder ex vivo oder in vivo, wie
hierin beschrieben.
-
Wünschenswerterweise
ist ein Vektor ein viraler Vektor, ausgewählt aus der Gruppe, welche
aus unbehüllten
Viren besteht. Ein derartiger Vektor umfasst wünschenswerterweise eine nicht-native
Aminosäuresequenz
gemäß der Erfindung
und/oder eine Nucleinsäuresequenz,
welche eine derartige nicht-native Aminosäuresequenz codiert. Optimalerweise
ist der Vektor ein adenoviraler Vektor, insbesondere ein adenoviraler Vektor,
ausgewählt
aus der Gruppe, welche besteht aus AdZ.FLAG, AdZ.RKKK2, AdZ.pGS,
AdZ.RGD, AdZ.pRGD, AdZ.pLDV und AdZ.pYIGSR.
-
Die
Mittel zur Herstellung der rekombinanten adenoviralen Vektoren gemäß der Erfindung
sind dem Fachmann bekannt. Beispielsweise können rekombinantes Adenovirus,
welches ein chimäres
Fiberprotein umfasst, und das rekombinante Adenovirus, welches zusätzlich ein
Passagiergen oder Gene, welche in der Lage sind, in einer bestimmten
Zelle exprimiert zu werden, umfasst, mittels eines Transfervektors
generiert werden, vorzugsweise mittels eines viralen oder plasmidischen
Transfervektors gemäß vorliegender
Erfindung. Ein derartiger Transfervektor umfasst vorzugsweise eine
chimäre
adenovirale Fiber-Sequenz, wie früher beschrieben. Die chimäre Fiberprotein-Gensequenz
umfasst eine nicht-native (d. h. Nicht-Wildtyp-)Sequenz an Stelle
der nativen Sequenz, welche deletiert worden ist, oder zusätzlich zu
der nativen Sequenz.
-
Eine
rekombinante chimäre
Fiberprotein-Gensequenz kann in einen oder von einem adenoviralen Vektor
von oder in ein Baculovirus oder einen geeigneten prokaryotischen
oder eukaryotischen Expressionsvektor überführt werden zur Expression und
Evaluierung von Rezeptor- oder Proteinspezifität und -avidität, Trimerisierungspotential,
Pentonbasis-Bindung und anderen biochemischen Charakteristika. Insbesondere
kann das Verfahren zur Proteinproduktion in Baculovirus verwendet
werden wie in den folgenden Beispielen dargelegt und wie von Wickham
et al. (1995), supra, beschrieben.
-
Demgemäß stellt
die vorliegende Erfindung ferner rekombinante baculovirale und prokaryotische
und eukaryotische Expressionsvektoren bereit, umfassend eine chimäre adenovirale
Fiberprotein-Gensequenz, welche ebenfalls Transfervektoren sein
können.
Die vorliegende Erfindung stellt ferner Vektoren bereit, welche unter
eine allgemein gebräuchliche
Definition von Transfervektoren fallen, z. B. Vektoren, die Adenovirus-Sequenzen
enthaltende Plasmide sind, welche zur Erzeugung neuer Adenovirus-Vektoren
verwendet werden. Die chimäre
Fiberprotein-Gensequenz umfasst eine nicht-native Sequenz zusätzlich zu
oder an Stelle einer nativen Aminosäuresequenz. Dies erlaubt dem
resultierenden chimären
Fiberprotein, an eine Bindungsstelle zu binden, welche von einer
Bindungsstelle, die von der nativen Sequenz gebunden wird, verschieden
ist. Durch Überführen des
chimären
Gens von einem adenoviralen Transfervektor in Baculovirus oder einen
prokaryotischen oder eukaryotischen Expressionsvektor ist eine hohe
Proteinexpression erzielbar (wobei die chimäre Fiber ca. 5–50% des
Gesamtproteins ausmacht). Bevorzugte Transfervektoren gemäß der Erfindung sind
ausgewählt
aus der Gruppe, welche besteht aus: p193(F5*), p193 F5F2K(FLAG),
p193 F5F2K, p193 F5F2K(RKKK2), p193(F5)pGS(RGD), p193(F5)pLDV, p193(F5)pYIGSR
und p193(F5*)RGD.
-
Ferner
kann ein erfindungsgemäßer Vektor
entweder innerhalb, an Stelle oder außerhalb der Codierungssequenz
eines Fiberproteins zusätzliche
Sequenzen umfassen, welche die Trimerisierungsfähigkeit des Fiberproteins beeinflussen,
oder er kann eine Protease-Erkennungssequenz umfassen. Eine Sequenz,
welche die Fähigkeit
zur Trimerisierung beeinflusst, umfasst eine oder mehrere Sequenzen,
welche Fiber-Trimerisierung erlauben. Eine Sequenz, welche eine
Protease-Erkennungssequenz umfasst, ist eine Sequenz, welche durch
eine Protease gespalten werden kann, wodurch die Entfernung des
chimären
Coat-Proteins (oder
eines Teils desselben) und Anheftung des rekombinanten Adenovirus
an eine Zelle mittels eines anderen Coat-Proteins bewirkt wird.
Bei Verwendung mit einem Fiberprotein beeinflusst die Protease-Erkennungsstelle
die Fiber-Trimerisierung oder Rezeptor-Spezifität des Fiberproteins vorzugsweise
nicht. Beispielsweise wird bei einer Ausführungsform der vorliegenden
Erfindung vorzugsweise das Fiberprotein oder ein Teil desselben
mittels einer Protease-Erkennungssequenz deletiert, und sodann befehligt
das Pentonbasis-Protein
oder ein anderes Protein Zellbindung/Zelleintritt.
-
Mit
Bezug auf die Produktion von Vektoren und Transfervektoren gemäß der Erfindung
werden Transfervektoren mittels molekularer und genetischer Standardtechniken,
wie sie dem Fachmann bekannt sind, konstruiert. Vektoren, welche
Virionen und Viruspartikel umfassen, werden mittels viraler Vektoren
in den geeigneten Zelllinien produziert. Ähnlich werden die adenovirale
Fiber-Chimäre enthaltenden
Partikel in Standardzelllinien produziert, z. B. solchen, wie sie
derzeit für
adenovirale Vektoren verwendet werden. Nach Produktion und Reinigung
werden die Partikel, in denen Fiber zu deletieren ist, fiberlos
gemacht durch Verdau der Partikel mit einer geeigneten sequenzspezifischen
Protease, welche die Fiberproteine spaltet und sie von den viralen
Partikeln trennt, um fiberlose Partikel zu generieren.
-
Illustrative Verwendungen
-
Die
vorliegende Erfindung stellt ein chimäres Fiberprotein bereit, welches
in der Lage ist, mit hoher Effizienz an Zellen zu binden und Zelleintritt
zu vermitteln, sowie Vektoren und Transfervektoren, welche dasselbe
umfassen. Das chimäre
Fiberprotein selbst hat multiple Verwendungen, z. B. als ein Werkzeug
für in-vitro-Studien
von Adenovirus-Bindung an Zeilen (z. B. durch Scatchard-Analyse, wie früher von
Wickham et al. (1993), supra, gezeigt), zum Blockieren von Adenovirus-Bindung
an Rezeptoren in vitro (z. B. mit Hilfe von Antikörpern, Peptiden
und Enzymen, wie in den Beispielen hierin beschrieben und wie auf
dem Fachgebiet bekannt) und, unter Verwendung einiger chimärer Fiberproteine,
welche bestimmte Peptidmotive umfassen, zum Schutz gegen adenovirale
Infektion in vivo durch Kompetition um die Bindung an die Bindungsstelle,
durch die Adenovirus Zelleintritt bewirkt.
-
Ein
Vektor, welcher ein chimäres
Fiberprotein umfasst, kann ferner zur Stammgenerierung und als ein Mittel
zum Herstellen neuer Vektoren verwen det werden. Beispielsweise kann
die nicht-native Aminosäuresequenz
intrazellulär
eingeführt
werden als ein Mittel zur Generierung neuer Vektoren via Rekombination. Ähnlich kann
ein Vektor in der Gentherapie verwendet werden. Beispielsweise kann
ein Vektor gemäß vorliegender Erfindung
verwendet werden zur Behandlung einer Anzahl von Erkrankungen durch
Delivery von korrektiver DNA, d. h. DNA, die eine Funktion codiert,
welche entweder fehlt oder beeinträchtigt ist, oder eines diskreten "Killing"-Agens, z. B. DNA,
die ein Cytotoxin codiert, welches z. B. nur intrazellulär aktiv
ist, in Zielzellen. Erkrankungen, die Kandidaten für eine derartige
Behandlung sind, umfassen beispielsweise Krebs, z. B. Melanom, Gliom
oder Lungenkrebs; genetische Störungen,
z. B. cystische Fibrose, Hämophilie
oder Muskeldystrophie; pathogene Infektionen, z. B. HIV, Tuberkulose
oder Hepatitis; Herzerkrankungen, z. B. die Verhinderung von Restenose
nach Angioplastie oder die Förderung
von Angiogenese zur Reperfusion von nekrotischem Gewebe; und Autoimmunkrankheiten,
z. B. Crohn'sche
Krankheit, Kolitis oder rheumatoide Arthritis.
-
Insbesondere
kann Gentherapie durchgeführt
werden bei der Behandlung von Krankheiten, Störungen oder Zuständen, welche
mit verschiedenen Geweben assoziiert sind, an die Adenovirus vor
der vorliegenden Erfindung nicht oder nur mit niedriger Affinität und/oder
Spezifität
binden und eintreten konnte. Beispielsweise kann das Verfahren verwendet
werden zum Inkorporieren einer Targeting-Sequenz, welche eine erhöhte Effizienz
des Gen-Delivery in verschiedene Gewebe erlaubt. Derartige Targeting-Sequenzen
umfassen, sind aber nicht beschränkt
auf: eine Heparin-Bindungsdomäne
(z. B. polyK, polyR oder Kombinationen hiervon); eine Integrin-Bindungsdomäne (z. B.
RGD, LDV und dergleichen); eine Laminin-Rezeptordomäne (z. B. YIGSR
[SEQ ID NO:66]); eine DNA-Bindungsdomäne (z. B. polyK, polyR oder
Kombinationen hiervon); Antikörper-Epitope
(z. B. das FLAG-Peptid DYKDDDDK [SEQ ID NO:2] oder ein anderes Epitop);
eine gehirnspezifische Targeting-Domäne (z. B. SLR); und eine beliebige
andere Peptid-Domäne,
welche an einen Rezeptor bindet (z. B. insbesondere eine Peptid-Domäne im Bereich
von ca. 2 bis 200 Aminosäuren).
-
Nach
diesen Grundsätzen
kann das Verfahren verwendet werden zur Erhöhung der Effizienz des adenoviral
vermittelten Delivery z. B. in Knochenmarkszellen, Endothel, Organe
wie Lunge, Leber, Milz, Nieren, Gehirn, Auge, Herz, Muskel und dergleichen,
hämatopoetische
Zellen, Tumorvaskulatur und Tumorzellen. Krankheiten, Störungen oder
Zustände,
welche mit diesen Geweben assoziiert sind, umfassen, sind aber nicht beschränkt auf:
Angiogenese, Restenose, Inflammation, Krebs, Alzheimer-Krankheit,
HIV-(HIV-1-, HIV-2-)Infektion und Anämien.
-
Diese
im Vorstehenden erwähnten
illustrativen Verwendungen sind keinesfalls erschöpfend, und
es ist beabsichtigt, dass die vorliegende Erfindung derartige weitere
Verwendungen umfasst, die sich aus der Offenbarung ableiten, aber
nicht explizit hierin angegeben sind. Ähnlich ergeben sich zahlreiche
Vorteile in Zusammenhang mit der Verwendung der verschiedenen Aspekte
der vorliegenden Erfindung.
-
Beispielsweise
wird bei Inkorporation von Antikörper-Epitopen
in das Fiberprotein, wenn das Antikörper-Epitop in einer Schleife
in der Nähe
der Fiber-Rezeptor-Bindungsdomäne ist,
die Bindung des bispezifischen Antikörpers die normale Rezeptorbindung
blockieren, wodurch die Zell-Targeting-Spezifität mittels des Antikörper-Epitops
erhöht
wird. Wenn die Fiber-Rezeptor-Bindungsdomäne so mutiert ist, dass sie
ihren Rezeptor nicht mehr bindet, dann wird die Inkorporation von
spezifischen Rezeptor-Bindungsdomänen in die Schleife ein Targeting
auf jene Gewebe, welche den komplementären Rezeptor exprimieren, in
der Abwesenheit jeglicher kompetierender Bindung, vermittelt durch
die Wildtyp-Fiber-Rezeptor-Bindungsdomäne, erlauben.
-
Ähnlich kann
ferner eine Domäne,
welche eine Inaktivierung der Fiber für ihre normale Rezeptorbindung
erlaubt, in eine exponierte Schleife des Fiberproteins inkorporiert
werden. Die Inaktivierung der Fiber-Bindung an ihren normalen Rezeptor
erlaubt spezifisches Targeting über
ein anderes Protein oder eine andere Domäne von Adenovirus. Beispielsweise
kann auf diese Weise αv-Integrin-Targeting mit nativer Pentonbasis durchgeführt werden.
Nach diesen Grundsätzen
kann eine Enterokinase-Spaltstelle (z. B. DYKDDDDK [SEQ ID NO:2])
oder eine Trypsin-Spaltstelle (z. B. RKKKRKKK) [SEQ ID NO:1]) in
eine Fiber-Schleife inkorporiert werden, gefolgt von einer Behandlung
von adeno viralen Partikeln mit Enterokinase oder Trypsin. Native
Adenovirus-Partikel sind immun gegen eine derartige Enterokinase-
oder Trypsin-Behandlung.
-
Ferner
ist ein erfindungsgemäßer Vektor,
insbesondere ein adenoviraler Vektor, vorteilhaft insofern, als
er durch konventionelle Mittel isoliert und gereinigt werden kann.
Da Änderungen
in dem Vektor auf der Genom-Ebene durchgeführt werden, sind keine beschwerlichen
und teuren Modifikationen nach der Produktion erforderlich, wie
sie mit anderen Vektoren verbunden sind (siehe z. B. Cotten et al.,
Proc. Natl. Acad. Sci., 89, 6094–6098 (1992); Wagner et al.,
Proc. Natl. Acad. Sci., 89, 6099–6103 (1992)). Ähnlich sind
keine speziellen Adenovirus-Rezeptor exprimierenden Zelllinien erforderlich.
Ein adenoviraler Vektor, welcher das chimäre Fiberprotein umfasst, kann
zu ähnlichen
Titern propagiert werden wie ein Wildtyp-Vektor, dem die Fiber-Modifikation
fehlt.
-
Mittel zur Verabreichung
-
Die
Vektoren und Transfervektoren gemäß vorliegender Erfindung können verwendet
werden, um entweder in vitro oder in vivo mit Zellen in Kontakt
gebracht zu werden. Erfindungsgemäß umfasst "Inkontaktbringen" beliebige Mittel, mit denen ein Vektor
intrazellulär
eingeführt
wird; das Verfahren ist nicht von besonderen Mitteln zur Einführung abhängig und
ist nicht so auszulegen. Mittel zur Einführung sind dem Fachmann wohlbekannt
und sind ferner beispielhaft hierin erläutert.
-
Demgemäß kann die
Einführung
z. B. entweder in vitro (z. B. in einem ex vivo-Verfahren der Gentherapie oder in Gewebekulturstudien)
oder in vivo durch Elektroporation, Transformation, Transduktion,
Konjugation oder "Triparental
Mating", (Co-)Transfektion,
(Co-)Infektion, Membranfusion mit kationischen Lipiden, Hochgeschwindigkeitsbombardement
mit DNA-umhüllten
Mikroprojektilen, Inkubation mit Calcium-Phosphat-DNA-Präzipitat,
direkte Mikroinjektion in einzelne Zellen und dergleichen bewirkt
werden. Ähnlich
können die
Vektoren mittels kationischer Lipide, z. B. Liposome, eingeführt werden.
Solche Liposome sind kommerziell erhältlich (z. B. Lipofectin
®,
Lipofectamine
TM und dergleichen von Life
Technologies, Gibco BRL, Gaithersburg, MD). Ferner können Liposome
mit erhöhter
Transferkapazität
und/oder reduzierter Toxizität
in vivo (siehe z. B. die Internationale Patentanmeldung Nr.
WO 95/21259 ) für die vorliegende
Erfindung verwendet werden. Ferner stehen andere Methoden zur Verfügung und
sind dem Fachmann bekannt.
-
Erfindungsgemäß umfasst
ein "Wirt" (und damit eine "Zelle" von einem Wirt)
einen beliebigen Wirt, in den ein erfindungsgemäßer Vektor eingeführt werden
kann, und umfasst somit ein Tier, einschließlich, aber nicht beschränkt auf
Amphibien, Vögel,
Fische, Insekten, Reptilien oder nicht-menschliche Säugetiere.
Optimalerweise ist ein Wirt ein Säugetier, z. B. ein Rodent,
Primat (z. B. Schimpanse, lang-, kurz-, ungeschwänzte Affen, Gorilla, Orang-Utan
oder Gibbon), Feline, Canine, Ungulat (z. B. Ruminant oder Schwein).
Wünschenswerterweise
ist eine solche Wirtszelle eine Zelle, in der ein Adenovirus für einen
Zeitabschnitt (z. B. typischerweise für irgendeinen Zeitraum bis
zu ca. zwei Monaten und potentiell auch länger) nach Eintritt in die
Zelle existieren kann.
-
Eine
Zelle kann als eine einzige Entität vorliegen oder sie kann Teil
einer größeren Zellsammlung
sein. Eine solche "größere Zellsammlung" kann z. B. umfassen:
eine Zellkultur (gemischt oder rein), ein Gewebe (z. B. epitheliales
oder anderes Gewebe), ein Organ (z. B. Herz, Lunge, Leber, Gallenblase,
Harnblase, Auge und andere Organe), ein Organsystem (z. B. das Zirkulationssystem,
das Respirationssystem, das gastrointestinale System, das Harnsystem,
das Nervensystem, das Haut- und Hautanhangsystem oder ein anderes
Organsystem), oder einen Organismus (z. B. Vogel, nicht-menschliches
Säugetier
oder dergleichen). Vorzugsweise ist das zum Zell-Targeting verwendete
Peptid-Bindungsmotiv so gewählt,
dass die Ziel-Organe/-Gewebe/-Zellen dem Zirkulationssystem (z.
B. einschließlich,
aber nicht beschränkt
auf Herz, Blutgefäße und Blut),
dem Respirationssystem (z. B. Nase, Pharynx, Larynx, Trachea, Bronchien,
Bronchiolien, Lunge und dergleichen), dem gastrointestinalen System
(z. B. einschließlich
Mund, Pharynx, Ösophagus,
Magen, Darm, Speicheldrüsen,
Pankreas, Leber, Gallenblase u. a.), dem Harnsystem (z. B. Nieren,
Ureter, Harnblase, Urethra und dergleichen), dem Nervensystem (z.
B. einschließlich,
aber nicht beschränkt
auf Gehirn und Rückenmark
und spezielle Sinnesorgane wie das Auge) und dem Haut- und Hautanhangsystem
(z. B. Haut) angehören.
Noch mehr bevorzugt sind die Zielzellen ausgewählt aus der Gruppe, welche
aus Herz-, hämatopoetischen,
Lungen-, Leber-, Milz-, Nieren-, Gehirn-, Au gen-, Knochenmarks-,
Endothel-, Muskel-, Tumorvaskulatur- und Tumorzellen besteht.
-
Für den Fachmann
wird erkennbar sein, dass geeignete Verfahren zur Verabreichung
eines Vektors (insbesondere eines adenoviralen Vektors) gemäß vorliegender
Erfindung an ein Tier zum Zwecke der Gentherapie (siehe z. B. Rosenfeld
et al., Science, 252, 431–434
(1991); Jaffe et al., Clin. Res., 39(2), 302A (1991); Rosenfeld
et al., Clin. Res., 39(2), 311A (1991); Berkner, BioTechniques,
6, 616–629
(1988); Crystal et al., Human Gene Ther., 6, 643–666 (1995); Crystal et al.,
Human Gene Ther., 6, 667–703
(1995)); Chemotherapie und Impfung zur Verfügung stehen und dass man zwar
mehr als eine Route zur Verabreichung verwenden kann, dass aber
die eine Route eine unmittelbarere und effektivere Reaktion bereitstellen
kann als die andere Route. Pharmazeutisch zulässige Exzipienten sind dem
Fachmann ebenfalls wohlbekannt und sind leicht verfügbar. Die
Wahl des Exzipienten wird zum Teil bestimmt durch das jeweilige
Verfahren, welches zur Verabreichung des rekombinanten Vektors verwendet
wird. Dementsprechend gibt es eine breite Vielfalt an geeigneten Formulierungen
zur Verwendung im Kontext der vorliegenden Erfindung. Die folgenden
Verfahren und Exzipienten sind rein exemplarisch und in keiner Weise
limitierend.
-
Weiter:
zur Optimierung der Fähigkeit
des Adenovirus zum Zelleintritt nach dem erfindungsgemäßen Verfahren
wird das Verfahren vorzugsweise durchgeführt in der Abwesenheit von
neutralisierenden Antikörpern,
die gegen das besondere Adenovirus, welches intrazellulär eingeführt wird,
gerichtet sind. In der Abwesenheit derartiger Antikörper besteht
keine Möglichkeit,
dass das Adenovirus durch den Antikörper gebunden und damit an
einer Bindung an die Zelle und/oder einen Eintritt in die Zelle
gehindert wird. Für
den Durchschnittsfachmann ist es leicht möglich, auf die Anwesenheit
derartiger neutralisierender Antikörper zu testen. Techniken,
welche auf dem Fachgebiet bekannt sind, können verwendet werden, um zu
verhindern, dass die Anwesenheit von neutralisierenden Antikörpern eine
effektive Proteinproduktion verhindert (siehe z. B. Crompton et
al., supra, Internationale Patentanmeldung
WO 96/12406 ).
-
Zur
oralen Verabreichung geeignete Formulierungen können bestehen aus: (a) flüssigen Lösungen,
z. B. aus einer wirksamen Menge der Verbindung, gelöst in Verdünnungsmitteln
wie Wasser, Kochsalzlösung oder
Orangensaft; (b) Kapseln, Sachets oder Tabletten, die jeweils eine
vorgegebene Menge der Aktivsubstanz als Feststoffe oder Granulen
enthalten; (c) Suspensionen in einer geeigneten Flüssigkeit;
und (d) geeignete Emulsionen. Tablettenformen können eine oder mehrere der
folgenden Komponenten umfassen: Lactose, Mannitol, Maisstärke, Kartoffelstärke, mikrokristalline
Cellulose, Acacia, Gelatine, kolloidales Siliciumdioxid, Croscarmellose-Natrium,
Talkum, Magnesiumstearat, Stearinsäure und andere Exzipienten,
Farbmittel, Verdünnungsmittel,
Pufferagenzien, Feuchthaltemittel, Konservierungsmittel, Geschmackstoffe
und pharmakologisch kompatible Exzipienten. Pastillenformen können die
Aktivsubstanz in einem Geschmackstoff umfassen, üblicherweise Saccharose und
Acacia oder Tragant, sowie Pastillen, welche die Aktivsubstanz in
einer inerten Grundlage umfassen, z. B. Gelatine und Glycerin oder
Saccharose und Acacia, Emulsionen, Gele und dergleichen, welche
neben der Aktivsubstanz solche Exzipienten enthalten, wie sie auf
dem Fachgebiet bekannt sind.
-
Ein
Vektor oder Transfervektor gemäß vorliegender
Erfindung kann – für sich allein
oder in Kombination mit anderen geeigneten Komponenten – zu Aerosol-Formulierungen verarbeitet
werden, welche durch Inhalation zu verabreichen sind. Diese Aerosol-Formulierungen
können
in zulässige
Drucktreibmittel eingebracht werden, z. B. Dichlordifluormethan,
Propan, Stickstoff und dergleichen. Sie können ferner als Arzneimittel
für drucklose
Zubereitungen, z. B. in Nebulisatoren oder Zerstäubern, formuliert werden.
-
Zur
parenteralen Verabreichung geeignete Formulierungen umfassen wässrige und
nichtwässrige
isotonische, sterile Injektionslösungen,
welche Antioxidantien, Puffer, Bakteriostatika und gelöste Substanzen, welche
die Formulierung auf Isotonie mit dem Blut des vorgesehenen Empfängers einstellen,
enthalten können,
sowie wässrige
und nichtwässrige
sterile Suspensionen, welche Suspensionsmittel, Lösungsvermittler, Verdickungsmittel,
Stabilisatoren und Konservierungsmittel umfassen können. Die
Formulierungen können
in versiegelten Einzeldosis- oder Mehrdosenbehältnissen, z. B. Ampullen und
Vials, dargeboten werden und können
in gefriergetrocknetem (lyophilisiertem) Zustand gelagert werden,
wobei nur die Zugabe des sterilen flüssigen Exzipienten wie Wasser
für Injektionen
unmittelbar vor Gebrauch erforderlich ist. Extemporane Injektionslösungen und
Suspensionen können
aus sterilen Pulvern, Granulen und Tabletten der früher beschriebenen
Art hergestellt werden.
-
Ferner
kann ein Vektor oder Transfervektor gemäß vorliegender Erfindung zu
Suppositorien verarbeitet werden durch Mischen mit einer Vielfalt
von Grundlagen, z. B. mit emulgierenden Grundlagen oder wasserlöslichen
Grundlagen.
-
Zur
vaginalen Verabreichung geeignete Formulierungen können als
Pessare, Tampons, Cremes, Gele, Pasten, Schaumpräparate oder Sprayformulierungen
dargeboten werden, welche neben der Aktivsubstanz solche Träger enthalten,
wie sie auf dem Fachgebiet als geeignet bekannt sind.
-
Die
einem Tier, insbesondere einem Menschen verabreichte Dosis im Kontext
der vorliegenden Erfindung variiert je nach dem interessierenden
Gen, der verwendeten Zusammensetzung, der Verabreichungsmethode
und dem jeweils behandelten Ort und Organismus. Die Dosis sollte
jedoch ausreichend sein, um eine therapeutische Antwort zu bewirken.
-
Wie
bereits angegeben, kann ein Vektor oder ein Transfervektor gemäß vorliegender
Erfindung auch in vitro Verwendung finden. Ein derartiger Vektor
kann als Forschungswerkzeug beim Studium der adenoviralen Anheftung
und Infektion von Zellen und in einem Verfahren zum Assay der Bindungsstelle-Ligand-Interaktion verwendet
werden. Ähnlich
kann das chimäre
Fiberprotein, welches eine eingeschränkte nicht-native Aminosäuresequenz
zusätzlich
zu oder an Stelle einer nativen Aminosäuresequenz umfasst, z. B. in
Rezeptor-Ligand-Assays
und als Adhäsionsprotein
in vitro oder in vivo verwendet werden.
-
Beispiele
-
Die
folgenden Beispiele dienen der weiteren Erläuterung der vorliegenden Erfindung
und sind selbstverständlich
nicht so auszulegen, dass sie den Bereich der Erfindung in irgendeiner
Weise begrenzen.
-
Beispiel 1
-
Dieses
Beispiel beschreibt die Konstruktion von Transfervektoren, welche
Fiber-Sequenzen codieren, die Insertionen von verschiedenen Peptidmotiven
in exponierten Schleifen der Knob-Region des Adenovirus-Fiberproteins
aufweisen.
-
Die
Fiberproteine von Ad2 und Ad5 erkennen beide denselben Rezeptor.
Eine parallele Evaluierung der Proteinstruktur des Fiber-Knob und
seiner DNA-Restriktionskarte zeigt, dass der Ad2-Fiber-Knob eine
singuläre
Spe I-Restriktionsstelle in einer Region enthält, welche eine exponierte
Schleife in dem Protein codiert. Die Aminosäuren in dieser Schleife sind
in keine Interaktionen involviert, welche für Proteinfaltung relevant sind.
Demgemäß ist es
unwahrscheinlich, dass Hinzufügungen
zu dieser Schleife die Fähigkeit
des Fiberproteins, sich zu falten, beeinflussen. Chimäre adenovirale
Fiberproteine, welche Modifikationen von einer exponierten Schleife
umfassen (insbesondere der HI-Schleife),
wurden konstruiert wie hierin beschrieben.
-
Zur
Vektorkonstruktion und -charakterisierung wurden molekulare und
genetische Standardtechniken durchgeführt, z. B. die Generierung
von Stämmen,
Plasmiden und Viren, Gelelektrophorese, DNA-Manipulationen, einschließlich Plasmidisolierung,
DNA-Klonierung und -Sequenzierung, Western-Blot-Assays und dergleichen,
wie sie dem Fachmann bekannt sind und im Detail in Standard-Laborhandbüchern beschrieben
sind (z. B. Maniatis et al., Molecular Cloning: A Laboratory Manual,
2nd ed. (Cold Spring Harbor, NY, 1992); Ausubel et al., Current
Protocols in Molecular Biology, (1987)). Restriktionsenzyme und
andere Enzyme, welche für
molekulare Manipulationen eingesetzt wurden, wurden von kommerziellen
Quellen bezogen (z. B. Boehringer Mannheim, Inc., Indianapolis,
Indiana; New England Biolabs, Beverly, Massachusetts; Bethesda Research
Laborstories, Bethesda, Maryland) und gemäß den Empfehlungen des Herstellers
verwendet. Für
Experimente verwendete Zellen (z. B. Zellen der transformierten
humanen embryonalen Nierenzelllinie 293 (d. h. CRL 1573-Zellen)
und andere, von American Type Culture Collection gelieferte Zellen)
wurden kultiviert und aufrechterhalten mittels steriler Standard-Kulturreagenzien,
-medien und -techniken, wie früher
beschrieben (Erzerum et al., Nucleic Acids Research, 21, 1607–1612 (1993)).
-
Zur
Herstellung von rekombinanten Adenovirus-Vektoren, welche Targeting-Sequenzen enthalten, durch
Ligation von Restriktionsverdaufragmenten war es zunächst notwendig,
die in einem Transfervektor präsente
Knob-Region des Ad5 gegen die Knob-Codierungsregion von Ad2 auszutauschen,
weil die HI-Schleife von
Ad2 eine singuläre
Spe I-Restriktionsstelle umfasst, welche Klonierung von bestimmten
Targeting-Sequenzen in diese Stelle erlaubt. Das Nettoergebnis dieser
Vektormanipulation war die Erzeugung einer Fiber-Chimäre, in welcher
die den Schwanz und den Schaft der Fiber codierende DNA von Ad5
stammt, die das Knob codierende DNA von Ad2 stammt und das Knob
ferner eine nicht-native Aminosäuresequenz
in der HI-Schleife aufweist, wie in 1 gezeigt.
Alternativ wurde eine Standard-Oligonucleotid-vermittelte ortsgerichtete
Mutagenese nach den Angaben des Herstellers (Stratagene, La Jolla,
CA) verwendet. Für
ortsgerichtete Mutagenese besteht keine Notwendigkeit, die Fiber-Knobs
auszutauschen, weil keine singulären
Restriktionsstellen erforderlich sind. Bei einem weiteren alternativen
Verfahren der Erfindung, welches in späteren Beispielen beschrieben
ist, wird die Targeting-Sequenz an den Terminus des Fiber-Knob-Proteins
platziert, wie in 2 gezeigt.
-
In
dem ersten Schritt des Verfahrens zur Herstellung von Fiber-Knob-Insertionen
in einer Schleife wurde der in
3 gezeigte
Transfervektor p193(F5*) konstruiert. Dieses Plasmid enthält eine
8-Nucleotid-Insertion zwischen dem letzten Aminosäure-Codon
der Fiber-Codierungssequenz und dem Stop-Codon. Die 8-Nucleotid-Insertion
enthält
eine singuläre
Bam HI-Restriktionsstelle, welche einen "Straightforward"-Austausch von Ad5-Fiber-Domänen mit
anderen Fiber-Domänen
von anderen Adenovirus-Serotypen erlaubt. Namentlich ist die Sequenz
des Wildtyp-Ad5-Fiber-Gens:
worin
* einen Terminations-Codon bezeichnet. Im Vergleich ist der C-Terminus
des mutierten Fiber-Gens, welches in p193(F5*) präsent ist:
worin
die unterstrichene Sequenz die in das Fiberprotein eingeführte Bam
HI-Stelle bezeichnet.
Diese Bam HI-Stelle dient ferner dazu, für die Aminosäuren Glycin
und Serin zu codieren.
-
Das
Transferplasmid p193(F5*) wurde aus p193NS(ΔF) konstruiert. Das mutierte
Fiber-Gen (d. h. das Fiber-Gen, welches die Bam HI-Stelle vor dem
Stop-Codon umfasst)
wurde in das Fiber-minus-Plasmid p193NS(ΔF) inkorporiert mittels synthetischer
Sense- und Antisense-Oligonucleotid-Primer, um das Fiber-Gen mittels
der Polymerase-Kettenreaktion (PCR) zu amplifizieren und dabei gleichzeitig
eine modifizierte Bam HI-Stelle auf den letzten Codon des Fiber-Gens
folgend zu inkorporieren, um das mutante Fiber-Gen zu erzeugen.
Die Primer, welche zum Amplifizieren von der Nde I-Stelle zu den
C-terminalen Codierungsregionen des Fiber-Gens aus Ad5-Genom-DNA
verwendet wurden, waren: Antisense-Primer T CCC CCC GGG TCT AGA TTA GGA TCC TTC TTG GGC AAT GTA
TGA (Bam HI-Stelle unterstrichen) [SEQ ID NO:10]; Sense-Primer CGT
GTA TCC ATA TGA CAC AGA (Nde
I-Stelle unterstrichen) [SEQ ID NO:11]. Das PCR-Produkt wurde dann
mit Nde I und Bam HI geschnitten und in die Nde I/Bam HI-Stellen
von p193NS(ΔF)
kloniert.
-
Das
Plasmid p193NS(ΔF)
selbst wurde konstruiert mittels einer intermediären Reihe von Vektoren. Namentlich
wurde zunächst
das Transferplasmid p193NS83-100 konstruiert durch Klonieren des
Ad5-Nde I-Sal I-Fragments, welches die Karteneinheiten-Region 83-100
des Ad5-Genoms überspannt,
welche das Fiber-Gen enthält,
in das Plasmid pNEB193 (New England Biolabs, Beverly, MA). Das Nde
I-Mun I-Fragment wurde ersetzt durch ein synthetisches Oligonucleotid,
umfassend eine Bam HI-Stelle, die von einer 5'-Nde I-Stelle und einer 3'-Mun I-Stelle flankiert war, um Klonierung
zu erleichtern. Das doppelsträngige
synthetische Oligonucleotid-Fragment wurde aus den überlappenden
synthetischen einzelsträngigen
Oligonucleotiden Sense (d. h. umfassend die Sequenz TAT GGA GGA
TCC AAT AAA GAA TCG TTT GTG TTA TGT TTC AAC GTG TTT ATT TTT C [SEQ
ID NO:12]) und Antisense (d. h. umfassend die Sequenz AAT TGA AAA
ATA AAC ACG TTG AAA CAT AAC ACA AAC GAT TCT TTA TTG GAT CCT CCA [SEQ ID NO:13]) erzeugt.
Die Enden der überlappenden
Oligomere wurden so erzeugt, dass Überhänge entstehen, die kompatibel
sind für
eine direkte Klonierung in die Nde I- und Mun I-Stellen. Dem resultierenden
Vektor p193NS(ΔF)
fehlt die komplette Codierungssequenz für das Fiber-Gen, er enthält aber
die gesamte adenovirale E4-Codierungssequenz. Das Plasmid behält das AATAAA-Polyadenylierungssignal
bei, welches in dem synthetischen Nde I/Mun I-Oligonucleotid enthalten
ist, und inkorporiert ferner die neue Bam HI-Restriktionsstelle.
-
Nach
seiner Konstruktion in einer Reihe von sequentiellen Klonierungsschritten
wurde also der Transfervektor P193(F5*) in nachfolgenden Vektorkonstruktionen
verwendet. Namentlich wurden das Sense-Oligonucleotid F5F2K(s)N
(d. h. umfassend die Sequenz GGC CAT GGC CTA GAA TTT GAT TCA AAC
GGT GCC ATG ATT ACT AAA CTT GGA GCG [SEQ ID NO:14], enthaltend eine
Nco I-Restriktionsstelle) und der Antisense-Oligonucleotid-Primer
F5F2K(a)B (d. h. umfassend die Sequenz GC GGA TCC TTA TTC CTG GGC AAT
GTA GGA [SEQ ID NO:15], enthaltend eine Bam HI-Restriktionsstelle)
verwendet, um die Knob-Codierungsregion
aus gereinigter Ad2-DNA mittels PCR zu amplifizieren. Die Inkorporation
dieser Stellen an beiden Enden des PCR-Produktes erlaubte, es mit
Nco I und Bam HI zu schneiden und in das Basisplasmid p193(F5*) zu
klonieren, um den in
4 gezeigten Transfervektor
p193 F5F2K zu erzeugen. Anders als p193(F5*) enthält p193
F5F2K eine singuläre
Spe I-Restriktionsstelle innerhalb des Ad2-Fiber-Gens, welche eine
exponierte Schleife in dem Protein codiert. Namentlich umfasst das
in p193 F5F2K präsente
Fiber-Gen die mutierte
Fiber-Sequenz
worin
die unterstrichene Sequenz die neue, in das Fiber-Gen eingeführte Spe
I-Stelle bezeichnet.
-
Dieser
Vektor wurde dann zum Klonieren von Targeting-Sequenzen in die Spe
I-Stelle verwendet. Insbesondere wurden eine Nucleinsäuresequenz,
welche das FLAG-Peptidmotiv DYKDDDDK (d. h. Asp Tyr Lys Asp Asp
Asp Asp Lys [SEQ ID NO:2]) codiert, und eine Nucleinsäuresequenz,
welche die Strecke von 8 basischen Aminosäuren RKKKRKKK (Arg Lys Lys
Lys Arg Lys Lys Lys [SEQ ID NO:1]), umfassend die Heparin-Bindungsdomäne, codiert,
in die Spe I-Stelle von p193 F5F2K mittels überlappender Sense- und Antisense-Oligonucleotide
kloniert.
-
Namentlich
umfasst die PolyGS(RKKK)
2-Sequenz:
-
Das
27-mere Sense-Oligonucleotid PolyGS(RKKK)2(s)
(d. h. umfassend die Sequenz CT AGA AAG AAG AAA CGC AAA AAG AAG
A [SEQ ID NO:20]) und das 27-mere Antisense-Oligonucleotid PolyGS(RKKK)2(a) (d. h. umfassend die Sequenz CT AGT
CTT CTT TTT GCG TTT CTT CTT T [SEQ ID NO:21]) wurden verwendet zum
Klonieren der PolyGS(RKKK)2-Sequenz, umfassend
das Peptidmotiv RKKKRKKK [SEQ ID NO:17]. Dieses Plasmid wurde konstruiert
durch Klonieren der die Bindungsdomäne codierenden DNA-Sequenz
in die Spe I-Stelle von p193 F5FK2. Die überlappenden Sense- und Antisense-Oligonucleotide, welche
die Bindungsdomäne
codieren, wurden zunächst "annealt" und dann direkt
in die Spe I-Restriktionsstelle ligiert, um in dem in 5 gezeigten
Plasmid p193 F5F2K(RKKK2) zu resultieren.
-
Ähnlich umfasst
die FLAG-Sequenz:
-
Das
30-mere Sense-Oligonucleotid FLAG(s) (d. h. umfassend die Sequenz
CT AGA GAC TAC AAG GAC GAC GAT GAT AAG A [SEQ ID NO:24]) und das
30-mere Antisense-Oligonucleotid
FLAG(a) (d. h. umfassend die Sequenz CT AGT CTT ATC ATC GTC GTC
CTT GTA GTC T [SEQ ID NO:25]) wurden verwendet zum Klonieren der
FLAG-Peptidsequenz auf eine ähnliche
Weise wie für
p193 F5F2K(RKKK2) beschrieben, um in dem in 6 gezeigten
Plasmid p193 F5F2K(FLAG) zu resultieren.
-
Die
FLAG-Sequenz wird von dem anti-FLAG M2-Antikörper (Kodak, New Hauen, CT)
erkannt und wird zum Targeting von Adenovirus mittels bispezifischer
Antikörper
verwendet (Wickham et al., "Targeted
Adenovirus Gene Transfer to Endothelial and Smooth Muscle Cells
Using Bispecific Antibodies",
J. Virol., 70(10), 6831–6838
(1996)). Die Peptid-Sequenz RKKKRKKK [SEQ ID NO:17] erkennt zelluläres Heparinsulfat
und wird zum Targeting des Adenovirus auf Heparinsulfat enthaltende
Rezeptoren auf Zellen verwendet. Weil Heparinsulfatreste auf nahezu
allen Säugetierzellen
exprimiert werden, erlaubt das Heparin-Bindungsmotiv AdF2K(RKKK2)
ein breites Spektrum von Zellen zu binden und zu transduzieren im
Vergleich zu unmodifizierten (d. h. Wildtyp-)Adenovirus-Vektoren.
-
Es
wurde bestätigt,
dass die Plasmide p193 F5F2K(RKKK2) und p193 F5F2K(FLAG) die korrekten
Inserte enthielten, durch die Verwendung von PCR-Analyse und Mobility-Shift-Assays,
durchgeführt
an durch Restriktionsverdauungen der Plasmide generierten DNA-Fragmenten.
Namentlich ist der relevante Bereich der modifizierten Schleife
des Fiber-Knob, welcher in p193 F5F2K(RKKK2) präsent ist:
-
Der
relevante Bereich der modifizierten Schleife des Fiber-Knob, welcher
in p193 F5F2K(FLAG) präsent
ist, ist:
-
Bei
einer anderen Ausführungsform
der Erfindung wurde ein zusätzliches
mutantes Fiberprotein durch ortsgerichtete Mutagenese erzeugt. Es
wurden Primer synthetisiert, um die DNA Sequenz, welche Aminosäuren der
CD-, FG- und IJ-Schleifen
des Ad5-Fiber-Knob codiert, zu ersetzen. Insbesondere wurde die
Sequenz, welche die Aminosäuresequenz
SGTVQ [SEQ ID NO:81] (Aminosäuren
449 bis 453 der CD-Schleife des nativen Ad5-Fiber-Knob) codiert,
durch DNA ersetzt, welche die Aminosäuresequenz Gly Ser Gly Ser
Gly [SEQ ID NO:82] codiert, durch Durchführung ortsgerichteter Mutagenese
des Plasmids pAcSG2 F5KN (Roelvink et al.) mittels der Primer
-
Ähnlich wurden
mittels geeigneter Primer für
ortsgerichtete Mutagenese die Aminosäuresequenzen Ser His Gly Lys
Thr Ala [SEQ ID NO:86] (Aminosäuren
507–512)
der FG-Schleife und Ser Gly His Asn [SEQ ID NO:87] (Aminosäuren 559–562) der
IJ-Schleife durch Gly Ser Gly Ser Gly Ser [SEQ ID NO:88] bzw. Gly
Ser Gly Ser [SEQ ID NO:89] ersetzt. Die resultierenden Baculovirus-Transfervektoren,
welche die mutierten Fiber-Knob-Gene enthielten, wurden zur Herstellung
von rekombinantem Baculovirus verwendet. Die rekombinanten Baculoviren
wurden verwendet, um rekombinante Fiber-Knob-Proteine, welche die
Mutationen enthalten, herzustellen. Es wurde gefunden, dass die
resultierenden Proteine voll löslich
waren, was anzeigt, dass sie sich korrekt zu Trimeren gefaltet hatten.
Ferner wurden die löslichen
Proteine verwendet, um Adenovirus-Bindung an Zellen zu blockieren,
was anzeigt, dass die Substitutionen in dem Fiber-Gen die Bindung
an den Fiber-Rezeptor nicht unterbrachen.
-
Diese
Resultate bestätigen
somit, dass die hierin beschriebenen Verfahren verwendet werden
können, um
Transfervektoren zu konstruieren, welche Fiber-Sequenzen codieren,
die Insertionen von verschiedenen Peptidmotiven in einer exponierten
Schleife der Knob-Region des Adenovirus-Fiberproteins aufweisen.
-
Beispiel 2
-
Dieses
Beispiel beschreibt die Konstruktion von adenoviralen Vektoren,
welche Fiber-Sequenzen codieren, die Insertionen von verschiedenen
Peptidmotiven in einer Schleife der Knob-Region des Adenovirus-Fiberproteins
aufweisen.
-
Die
Transferplasmide p193 F5F2K(RKKK2) und p193 F5F2K(FLAG) wurden verwendet,
um die korrespondierenden adenoviralen Vektoren zu erhalten, welche
die FLAG- und RKKK2-Peptidmotive umfassen. Erreicht wurde dies durch
Verdau dieser Plasmide (welche die essentielle E4-Region von Adenovirus
enthalten) mit Sal I und Transfektion derselben in 293-Zellen, welche
bereits 1 Stunde zuvor mit dem Adenovirus-Vektor AdZ.E4Gus infiziert
worden waren. Diesem Adenovirus-Vektor fehlt die E4-Region, und
er kann in 293-Zellen ohne die E4-Gene nicht replizieren. Erst wenn
AdZ.E4Gus-DNA mit Plasmid-DNA,
z. B. p193 F5F2K, p193 F5F2K(FLAG) und p193 F5F2K(RKKK2), rekombiniert,
um die E4-Gene zu erhalten, ist der Vektor fähig, in 293-Zellen zu replizieren.
Während
dieser Rekombination zur Rettung des adenoviralen Vektors nimmt
der neu gebildete Vektor ferner die durch die Plasmide codierte
mutierte Fiber-Sequenz auf.
-
Lebensfähiges rekombinantes
E4+-Adenovirus, enthaltend die F2K(RKKK2)- und F2K(FLAG)-DNA-Sequenzen
(d. h. AdZ.FLAG und AdZ.RKKK2), wurde durch Plaquebildung der transfizierten Zelllysate
5 Tage nach Transfektion isoliert. Die rekombinanten Adenoviren
wurden dann zweimal auf 293-Zellen Plaque-gereinigt. Die gereinigten
Plaques wurden auf 293-Zellen amplifiziert. Alle Viren wurden aus
infizierten Zellen 2 Tage post Infektion in 3 Gefrier-Tau-Zyklen
gereinigt, gefolgt von zwei sukzessiven Bandenbildungen auf CsCl-Gradienten.
Das gereinigte Virus wurde gegen 10 mM Tris, 150 mM NaCl, pH 7,8,
enthaltend 10 mM MgCl2, 3% Saccharose, dialysiert
und bei –80°C eingefroren, bis
es gebraucht wird. Durch PCR wurde verifiziert, dass die gereinigten
Viren entweder das RKKK2-Insert oder das FLAG-Insert enthielten.
-
Diese
adenoviralen Vektoren und die Sequenzen, die sie spezifisch gezielt
ansteuern infolge ihres Besitzes von modifizierten Fiber-Knobs,
sind in Tabelle 1 aufgezeigt. Tabelle
1 Adenovirale Vektoren umfassend eingeschränkte Peptidmotive
-
Diese
Resultate bestätigen
somit, dass die hierin beschriebenen Verfahren verwendet werden
können, um
adenovirale Vektoren zu konstruieren, welche Fiber-Sequenzen codieren,
die Insertionen von verschiedenen Peptidmotiven in einer exponierten
Schleife der Knob-Region des Adenovirus-Fiberproteins aufweisen.
-
Beispiel 3
-
Dieses
Beispiel beschreibt die Charakterisierung von adenoviralen Vektoren,
welche Fiber-Sequenzen codieren, die Insertionen von verschiedenen
Peptidmotiven in einer Schleife der Knob-Region des Adenovirus-Fiberproteins
aufweisen.
-
Es
wurde gezeigt, dass das in dem AdZ.FLAG-Vektor präsente FLAG-Insert
funktional zugänglich
und zur Bindung des anti-FLAG-M2-mAB befähigt war, wie abgeschätzt mittels
Immunofluoreszenz, wie früher
beschrieben (Wickham et al., 1993). Kurz gefasst wurden 293-Zellen
bei einer niedrigen Multiplizität
der Infektion (d. h. bei einem MOI-Wert von ca. 0,02) mit den AdZ.RKKK2- oder AdZ.FLAG-Isolaten
infiziert. Die Zellen wurden zwei Tage post Infektion fixiert und
entweder mit einem polyklonalen Kaninchen-anti-Pentonbasis-Antikörper oder
einem Maus-anti-FLAG-mAB inkubiert, gefolgt von Inkubation mit anti-Kaninchen-
oder anti-Maus-FITC-Antikörper.
Der anti-Pentonbasis-Antikörper
erkannte mit jedem der beiden Viren infizierte Zellen. Im Vergleich
dazu erkannte der FLAG-mAB nur die mit dem AdZ.FLAG-Virus infizierten
Zellen, nicht aber die mit dem AdZ.RKKK2-Virus infizierten Zellen.
-
Diese
Resultate bestätigen,
dass gemäß dem erfindungsgemäßen Verfahren
produzierte Adenoviren lebensfähig
sind und dass das Insert (z. B. das FLAG-Epitop), welches in einer exponierten
Schleife von Fiberprotein präsent
ist, zugänglich
ist für
seine korrespondierende Bindungsentität (z. B. eine Zelloberflächen-Bindungsstelle
oder einen Antikörper,
z. B. den anti-FLAG-Antikörper)
und dieselbe zu binden vermag. Diese Resultate bestätigen, dass
das erfindungsgemäße Verfahren
für adenoviral
vermitteltes Zell-Targeting verwendet werden kann.
-
Beispiel 4
-
Dieses
Beispiel beschreibt Gen-Delivery, vermittelt durch adenovirale Vektoren,
welche Fiber-Sequenzen codieren, die Insertionen von verschiedenen
Peptidmotiven in einer exponierten Schleife der Knob-Region des
Adenovirus-Fiberproteins
aufweisen.
-
Zum
Testen der Fähigkeit
des RKKK2-Motivs, Zell-Targeting zu bewirken, wurden 293-Zellen
(welche relativ hohe Levels des Rezeptors, über den Wildtyp-Adenovirus-Fiberprotein
Zelleintritt bewirkt, zu exprimieren scheinen) für 30 Minuten in der Anwesenheit
und in der Abwesenheit von kompetierendem Wildtyp-Fiberprotein vorinkubiert.
Gereinigte AdZ- oder AdZ.RKKK2-Vektoren wurden sodann mit den Zellen
für weitere
60 Minuten bei 37°C
inkubiert. Die Zellen wurden dreimal mit PBS gewaschen und über Nacht
in Kulturmedium inkubiert. Sodann wurde aus lysierten Zellen die β-Galactosidase-Aktivität mittels
eines fluorometrischen β-Galactosidase-Assay-Kit
(Tropix, Redford, MA) bestimmt. Die Aktivität wurde in einem Luminometer
in relativen Lichteinheiten (RLU) gemessen.
-
Die
in 7 illustrierten Daten demonstrieren Gen-Delivery
in 293-Zellen, bewirkt durch den AdZ.RKKK2-Vektor. Wie aus dieser
Figur ersichtlich, blockierte das rekombinante Wildtyp-Fiberprotein Gen-Delivery
durch AdZ, nicht aber Gen-Delivery durch AdZ.RKKK2. Der AdZ.RKKK2-Vektor
war in der Lage, den Fiber-vermittelten Block von adenoviral vermitteltem
Gen-Delivery zu überwinden.
-
Diese
Resultate bestätigen,
dass dieses eingeschränkte
Peptidmotiv, welches in der Fiber-Schleife präsent ist, in der Lage ist,
Zellbindung/-eintritt effizient zu vermitteln. Ferner bestätigen die
Resultate weiter, dass adenovirale Vektoren, welche Fiber-Sequenzen
codieren, die Insertionen von verschiedenen Peptidmotiven in einer
exponierten Schleife des Knob des Adenovirus-Fiberproteins aufweisen,
zum Delivery (z. B. von DNA und/oder Protein) in Zellen verwendet
werden können.
-
Beispiel 5
-
Dieses
Beispiel beschreibt andere Oligonucleotide, welche zum Inserieren
einer nicht-nativen Aminosäuresequenz
in ein chimäres
Adenovirus-Fiberprotein, vorzugsweise in eine exponierte Schleife
des Adenovirus-Fiber-Knob, aber auch am C-Terminus des Proteins,
verwendet werden können.
-
Die
in dem vorausgehenden Beispiel beschriebenen Klonierungstechniken
können
verwendet werden, um in eine exponierte Schleife des Fiber-Knob
Inserte zu inkorporieren, welche Peptidmotive umfassen, die z. B. αv-Integrine, α5β1-Integrin,
FLAG-mAb oder andere Zelloberflächen-Bindungsstelle
gezielt ansteuern.
-
Insbesondere
kann eine HAαv-Sequenz inseriert werden.
-
-
Die
Sequenz kann inseriert werden unter Verwendung des 39-meren Sense-Oligonucleotids HAαv(s) (d.
h. umfassend die Sequenz CT AGA GCC TGC GAC TGT CGC GGC GAT TGT
TTT TGC GGT A [SEQ ID NO:32]) und des 30-meren Antisense-Oligonucleotids
HAαv(a)
(d. h. umfassend die Sequenz CT AGT ACC GCA AAA ACA ATC GCC GCG
ACA GTC GCA GGC T [SEQ ID NO:33]). Diese Oligonucleotide wurden
zur Herstellung von p193(F5*)pGS(RGD) verwendet, welches zur Herstellung
von AdZ.RGD verwendet wurde.
-
Ähnlich kann
eine HAα
5β
1-Sequenz inseriert werden, welche Targeting
auf α5β1-Integrin
erlaubt. Diese repräsentative
Sequenz umfasst:
-
Die
Sequenz kann inseriert werden unter Verwendung des 39-meren Sense-Oligonucleotids HAα5β1(s)
(d. h. umfassend die Sequenz CT AGA TGC CGC CGC GAA ACC GCT TGG
GCC TGT A [SEQ ID NO:36]) und des 39-meren Antisense-Oligonucleotids
HAα5β1(a) (d. h. umfassend die Sequenz CT AGT
ACA GGC CCA AGC GGT TTC GCG GCG GCA T [SEQ ID NO:37]).
-
Diese
Sequenzen (und andere hierin beschriebene Sequenzen), welche Targeting
auf die αv-Integrine erlauben, können Verwendung finden, weil
dieser Zielrezeptor eine breite Verteilung demonstriert, einschließlich Endothelzellen
und glatte Muskelzellen. Der Adhäsionsrezeptor
scheint wichtig zu sein bei Wunden (d. h. betreffend sowohl Heilung
als auch Exazerbation derselben), sowie in der Angiogenese, Restenose
und Metastasierung. Allgemein ist der Rezeptor in proliferierenden
Endothelzellen und glatten Muskelzellen aufreguliert und zeigt hohe
Expression in Melanom und Gliom. Normale Liganden für die αv-Integrin-Rezeptoren
umfassen Vitronectin, Collagen, Fibronectin, Laminin und Osteopontin.
-
Ferner
kann eine E-Selectin-Targeting-Sequenz inseriert werden. Eine repräsentative
Sequenz umfasst:
-
Weitere
Liganden, welche Elastin binden, sind im Stand der Technik beschrieben
und können ähnlich als
nicht-native Aminosäuresequenzen
für die
Generierung von Peptidmotiven wie hierin beschrieben verwendet werden
(siehe z. B. Martens et al., J. Biolog. Chem., 270, 21129–21136 (1995)).
Die E-Selectin-Sequenz kann inseriert werden unter Verwendung des
42-meren Sense-Oligonucleotids
E-Selectin(s) (d. h. umfassend die Sequenz CT AGA GAC ATT ACC TGG
GAC CAG CTT TGG GAC CTT ATG AAG A [SEQ ID NO:40]) und des 42-meren
Antisense-Oligonucleotids E-Selectin(a) (d. h. umfassend die Sequenz
CT AGT CTT CAT AAG GTC CCA AAG CTG GTC CCA GGT AAT GTC T [SEQ ID
NO:41]).
-
Ferner
können
eine PolyGS(RKKK)
3-Sequenz oder andere Variationen
dieser Sequenz inseriert werden. Diese Sequenz umfasst:
-
Die
Sequenz kann inseriert werden unter Verwendung des 39-meren Sense-Oligonucleotids PolyGS(RKKK)3(s) (d. h. umfassend die Sequenz CT AGA
AAG AAG AAG CGC AAA AAA AAA AGA AAG AAG AAG A [SEQ ID NO:44]) und
des 39-meren Antisense-Oligonucleotids PolyGS(RKKK)3(a)
(d. h. umfassend die Sequenz CT AGT CTT CTT CTT TCT TTT TTT TTT
GCG CTT CTT CTT T [SEQ ID NO:45]).
-
Dieses
Beispiel bestätigt
somit, dass andere Oligonucleotide verwendet werden können zum
Inserieren einer nicht-nativen Aminosäuresequenz in ein Fiberprotein.
Derartige Insertionen können
entweder in einer exponierten Schleife des Adenovirus-Fiber-Knob
oder, wie im Folgenden beschrieben, am C-Terminus des Fiberproteins
durchgeführt
werden. Ferner kann die nicht-native Aminosäuresequenz in das chimäre Fiberprotein
nicht nur als eine Insertion in die Sequenz inkorporiert werden,
sondern auch als ein Austausch von adenoviralen Sequenzen. Durchgeführt werden
kann dies durch Modifikation der hierin beschriebenen Klonierungsprozeduren,
wie sie dem Fachmann bekannt sind.
-
Beispiel 6
-
In
einer ähnlichen
Weise wie die durch Platzierung eines Peptidmotivs innerhalb einer
exponierten Schleife des Adenovirus-Fiberproteins erzielte Einschränkung kann
eine Einschränkung
durch geeignete Modifikation eines Peptidmotivs am C-Terminus des
Fiberproteins erhalten werden, um im Wesentlichen eine nicht-präexistierende
Schleife an dieser Stelle zu erzeugen. Dieses Beispiel beschreibt
also die Konstruktion von Transfervektoren, welche Fiber-Sequenzen codieren,
die Insertionen von verschiedenen eingeschränkten Peptidmotiven am C-Terminus
des Adenovirus-Fiberproteins aufweisen. Dieses Verfahren ist in 2 dargestellt.
-
Der
in Beispiel 1 beschriebene Transfervektor p193(F5*) wurde als ein
Basisplasmid verwendet, um chimäre
Adenovirus-Partikel zu erzeugen, welche C-terminale Hinzufügungen zu
dem Fiber-Gen enthalten. Insbesondere wurden DNA-Sequenzen, welche
eine Linker-Sequenz gefolgt von einer Targeting-Sequenz und einem
Stop-Codon codieren, in die Bam HI-Stelle kloniert, um weitere Transfervektoren
zu erzeugen, die ihrerseits (d. h. über die Konstruktion der weiteren
Transfervektoren p193(F5)pGS(RGD) und p193(F5)pGS) zur Herstellung
von chimären
Adenovirus-Partikeln verwendet wurden.
-
Die
mutanten Transferplasmide, welche Sequenzen enthalten, die einen
Glycin/Serin-Aminosäure-Repeat-Linker,
eine Targeting-Sequenz und einen Stop- Codon codieren, wurden hergestellt durch
Klonieren von synthetischen Oligonucleotiden in die Bam HI-Stelle
von p193(F5*). Die Klonierungsreaktionen wurden im Wesentlichen
durchgeführt
wie in Beispiel 1 beschrieben. Insbesondere waren die überlappenden
synthetischen Oligonucleotide, welche zur Herstellung des in 8 gezeigten
Transferplasmids p193(F5)pGS(RGD) verwendet wurden, folgende: Sense,
GA TCA GGA TCA GGT TCA GGG AGT GGC TCT GCC TGC GAC TGT CGC GGC GAT
TGT TTT TGC GGT TAA G [SEQ ID NO:46]; Antisense, GA TCC TTA ACC
GCA AAA ACA ATC GCC GCG ACA GTC GCA GGC AGA GCC ACT CCC TGA ACC
TGA TCC T [SEQ ID NO:47]. Dieses Plasmid umfasst die Nucleinsequenz
GCC CAA GAA GGA TCA GGA TCA GGT TCA GGG AGT GGC TCT GCC TGC GAC
TGT CGC GGC GAT TGT TTT TGC GGT TAA GGA TCC AAT AA [SEQ ID NO:48],
welche die Aminosäuresequenz
Ala Gln Glu Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Ala Cys Asp
Cys Arg Gly Asp Cys Phe Cys Gly *** [SEQ ID NO:49] codiert, worin
*** sich auf den Stop-Codon bezieht. Das RGD-Peptid ist innerhalb
dieser größeren Sequenz
präsent.
Das Plasmid p193(F5)pGS(RGD) umfasst also die Targeting-Sequenz
CDCRGDCFC (d. h. Cys Asp Cys Arg Gly Asp Cys Phe Cys [SEQ ID NO:3]),
welche in der größeren Sequenz
Ser Ala Cys Asp Cys Arg Gly Asp Cys Phe Cys Gly [SEQ ID NO:79] präsent ist.
Diese Sequenz, wie andere, früher
beschriebene Sequenzen, welche das Tripeptidmotiv RGD enthalten,
fungieren als ein Ligand für
die Zielrezeptor-α5-Integrine. Jedoch binden hoch eingeschränkte Formen
von RGD mit höheren
Affinitäten an
Integrine als lineare Formen (siehe z. B. Aumailley et al., FEBS,
291, 50–54
(1991); Cardarelli et al., J. Biolog. Chem., 269., 18668–18673 (1994);
Koivunen et al., Bio/Technology, 13, 265–270 (1995)). Nach diesen Grundsätzen bindet
das eingeschränkte
RGD-Targeting-Motiv,
welches in p193(F5)pGS(RGD) präsent
ist, mit ca. 100fach höherer
Affinität
an αv-Integrine als ähnliche, lineare RGD-Motive.
Jedes Paar von Cysteinen beiderseits des RGD bildet Disulfidbindungen
mit dem gegenüberliegenden
Paar von Cysteinen, um eine hoch eingeschränkte RGD-Schleife zu bilden.
-
Ferner
können
Variationen der Targeting-Sequenz CRCRGDCFC [SEQ ID NO:3] im Kontext
der vorliegenden Erfindung verwendet werden. Beispielsweise kann
an Stelle von zwei Cysteinresten beiderseits der RGD-Tripeptid-Sequenz
nur ein Rest verwendet werden. Es kann eine beliebige Sequenz verwendet
werden, solange eine schleifenähnliche
Struktur erzeugt wird, welche die RGD-Sequenz umfasst, und solange
die Sequenz ein oder mehrere Cysteinpaare umfasst. Ferner kann die
RGD-Sequenz mit einer anderen Sequenz substituiert werden, z. B.
LDV.
-
Mit
Bezug auf die Konstruktion des verwandten Transferplasmids p193(F5)pGS
waren die überlappenden
synthetischen Oligonucleotide, welche zur Herstellung des Transferplasmids
verwendet wurden, folgende: Sense, PolyGS(s), GA TCC GGT TCA GGA
TCT GGC AGT GGC TCG ACT AGT TAA A [SEQ ID NO:50]; Antisense, PolyGS(a),
GA TCT TTA ACT AGT CGA GCC ACT GCC AGA TCC TGA ACC G [SEQ ID NO:51].
Die Sense- und Antisense-Oligonucleotide wurden in äquimolaren
Verhältnissen
gemischt und in die Bam HI-Stelle von p193(F5*) kloniert, um p193(F5)pGS
zu erzeugen. Der Transfervektor p193(F5)pGS wurde sodann verwendet,
um weitere Transfervektoren zu konstruieren, wie in den folgenden
Beispielen beschrieben.
-
Dieses
Beispiel bestätigt
somit, dass Transfervektoren, welche Fiber-Sequenzen codieren, die
Insertionen von verschiedenen eingeschränkten Peptidmotiven am C-Terminus
des Adenovirus-Fiberproteins aufweisen, gemäß der Erfindung konstruiert
werden können.
Ferner können
auch andere Transfervektoren (d. h. mit verschiedenen Targeting-Sequenzen)
mittels dieses Ansatzes konstruiert werden.
-
Beispiel 7
-
Dieses
Beispiel beschreibt die Konstruktion von Adenovirus-Vektoren, welche
Fiber-Sequenzen codieren, die Insertionen von verschiedenen eingeschränkten Peptidmotiven
am C-Terminus des Adenovirus-Fiberproteins aufweisen.
-
Das
für diese
Experimente verwendete E1- und E3-deletierte Adenovirus AdZ enthält das β-Galactosidase-Gen
unter der Kontrolle eines Cytomegalovirus(CMV-)Promotors und im
adenoviralen Genom integriert. AdZ wurde in humanen embryonalen
Nieren-293-Zellen propagiert, welche die komplementäre E1-Region
für Viruswachstum
enthalten. AdZ.RGD (sowie andere Vektoren, welche auf andere Adhäsionsrezeptoren zielgesteuert
sind, wie hierin be schrieben), wurde direkt von AdZ abgeleitet.
Diese Viren sind ebenfalls E1- und E3-deletiert
und sind identisch zu AdZ bis auf die Gegenwart zusätzlicher
Aminosäuren
am C-Terminus der Fiberproteine.
-
Die
Transferplasmide p193(F5)pGS und p193(F5)pGS(RGD), welche die essentielle
E4-Region von Adenovirus enthalten, wurden für adenovirale Vektorkonstruktion
verwendet. Diese Transferplasmide wurden mit Sal I geschnitten und
in 293-Zellen transfiziert, welche bereits 1 Stunde zuvor mit dem
Adenovirus-Vektor AdZ.E4Gus infiziert worden waren. Dem Adenovirus-Vektor
AdZ.E4Gus fehlt die E4-Region, und er kann in 293-Zellen ohne die
E4-Gene nicht replizieren. Erst wenn AdZ.E4Gus-DNA mit der p193(F5)pGS-
oder p193(F5)pGS(RGD)-Plasmid-DNA rekombiniert, um die E4-Gene zu
erhalten, ist der Vektor in der Lage, in 293-Zellen zu replizieren.
Während
dieser Rekombination nimmt der neu gebildete Vektor ferner die in
den Plasmiden codierten Fiber-Mutationen auf. Lebensfähige rekombinante
E4+-Adenoviren, welche die pGS- und pGS(RGD)-Mutationen
enthalten, wurden sodann durch Plaquebildung der transfizierten
Zelllysate 5 Tage nach Transfektion isoliert. Ihre resultierenden
Vektoren AdZ.pGS und AdZ.RGD wurden durch zwei aufeinanderfolgende
Plaquebildungsrunden auf 293-Zellen isoliert und gereinigt. Es wurde
verifiziert, dass jeder Vektor das korrekte Insert enthielt, durch
Sequenzierung von PCR-Produkten aus Virus-DNA, welche die Region
der Insert-DNA überspannt.
-
Dieses
Beispiel bestätigt,
dass Adenovirus-Vektoren, welche Fiber-Sequenzen codieren, die Insertionen
von verschiedenen eingeschränkten
Peptidmotiven am C-Terminus des Adenovirus-Fiberproteins aufweisen,
gemäß der Erfindung
konstruiert werden können.
-
Beispiel 8
-
Dieses
Beispiel beschreibt die Konstruktion von Transfervektoren und adenoviralen
Vektoren unter Verwendung anderer Oligonucleotide, welche zum Inserieren
einer nicht-nativen Aminosäuresequenz
in ein chimäres
Adenovirus-Fiberprotein,
vorzugsweise in eine exponierte Schleife des Adenovirus-Fiber-Knob, aber auch am
C-Terminus des Proteins, verwendet werden können.
-
Die
in Beispiel 6 beschriebenen Klonierungstechniken wurden verwendet,
um Hinzufügungen
an dem C-Terminus zu erzeugen. Im Wesentlichen wurden die in diesem
Beispiel beschriebenen Transfervektoren (insbesondere der Transfervektor
p193(F5)pGS) an der in den Vektoren präsenten singulären Klonierungsstelle
Spe I linearisiert, und neue Sequenzen wurden an dieser Stelle inseriert.
Andere Mittel (z. B. PCR-Reaktionen) können ebenfalls verwendet werden,
um Insertionen in diese singuläre
Stelle durchzuführen. Ähnlich können die
in Beispiel 5 beschriebenen Klonierungstechniken verwendet werden,
um in eine exponierte Schleife des Fiber-Knob Inserte zu inkorporieren,
welche Peptidmotive umfassen, die andere Zelloberflächen-Bindungsstellen
oder Epitope für
einen Antikörper
gezielt ansteuern.
-
Insbesondere
wurden multiple Kopien der RGD-Sequenz (d. h. polyRGD- oder pRGD-Sequenz)
inseriert. Diese Sequenz umfasst:
-
Die
Sequenz wurde inseriert unter Verwendung des Sense-Oligonucleotids
pRGDs (d. h. umfassend die Sequenz CT AGT GGA AGA GGA GAT ACT TTT
GGC CGC GGC GAC ACG TTC GGA AGG GGG GAT ACA TTT T [SEQ ID NO:54])
und des Antisense-Oligonucleotids pRGDs (d. h. umfassend die Sequenz
CT AGA AAA TGT ATC CCC CCT TCC GAA CGT GTC GCC GCG GCC AAA AGT ATC
TCC TCT TCC A [SEQ ID NO:55]).
-
Das
resultierende Plasmid p193(F5*)RGD wurde verwendet, um das Adenovirus
AdZ.pRGD zu erzeugen. Ein Vergleich der in AdZ.RGD und AdZ.pRGD
präsenten
Inserte (wobei das RGD-Peptid fett hervorgehoben ist) ist in Tabelle
2 vorgestellt. Tabelle
2 Vergleich der adenoviralen Vektoren AdZ.RGD und AdZ.pRGD
-
Ähnlich können eine
oder mehrere Kopien einer LDV-Targeting-Sequenz inseriert werden.
Der LDV-Zielrezeptor ist in hämatopoetischen
Zellen, Lymphocyten und Monocyten/Makrophagen verteilt. Der Adhäsionsrezeptor
ist hoch exprimiert auf ruhenden Lymphocyten, welche in Zell-Matrix-
und Zell-Zell-Interaktionen
involviert sind (z. B. während
hämatopoetischer
Extravasation sowie Inflammation und Lymphocyten-"Trafficking"). Liganden für den α4-Integrin-Zielrezeptor
umfassen, sind aber nicht begrenzt auf Fibronectin (ein Extrazellulärmatrixprotein),
VCAM-1 (welches Wechselwirkung mit Endothelgewebe vermittelt) und
MAdCAM (α4β7) (welches darmspezifisch ist). Insbesondere
umfassen die α4-Integrin-Targeting-Sequenzen die Sequenz
EILDVPST (d. h. Glu Ile Leu Asp Val Pro Ser Thr [SEQ ID NO:56],
welche von der obigen Sequenz umfasst ist, und die Sequenz (EILDVPS)3 (oder drei Kopien des Peptidmotivs EILDVPS
[SEQ ID NO:80] in Tandem, oder Glu Ile Leu Asp Val Pro Ser Glu Ile
Leu Asp Val Pro Ser Glu Ile Leu Asp Val Pro Ser) [SEQ ID NO:57].
-
Insbesondere
können
multiple Kopien der LDV-Sequenz (d. h. eine polyLDV- oder pLDV-Sequenz)
inseriert werden, um die Sequenz:
zu umfassen.
-
Diese
Sequenz wurde inseriert unter Verwendung des Sense-Oligonucleotids
pLDVs (d. h. umfassend die Sequenz CT AGT GAA ATT CTT GAC GTC GGA
GAG ATC CTC GAC GTC GGG GAA ATA CTG GAC GTC T [SEQ ID NO:60]) und
des Antisense-Oligonucleotids pLDVs (d. h. umfassend die Sequenz
CT AGA GAC GTC CAG TAT TTC CCC GAC GTC GAG GAT CTC TCC GAC GTC AAG
AAT TTC A [SEQ ID NO:61]).
-
Diese
Insertion resultierte in der Generierung des in 9 gezeigten
Vektors p193(F5)pLDV. Das in diesem Vektor präsente LDV-Targeting-Motiv (d.
h. umfassend die Sequenz SEQ ID NO:59) bindet mit submillimolarer
Affinität
an α4-Integrine. Das LDV-Motiv ist dreimal wiederholt
in jedem Fiber-Monomer, so dass sich insgesamt 9 Motive pro Fiber-Molekül ergeben.
Dieser Vektor wurde ferner für
die Generierung eines korrespondierenden adenoviralen Vektors verwendet.
-
Ferner
wurde eine pYIGSR-Targeting-Sequenz am C-Terminus des Fiberproteins
inseriert, um das in
10 gezeigte Plasmid p193(F5)pYIGSR
abzuleiten. Das Fiberprotein in diesem Plasmid umfasst die Aminosäuresequenz:
-
Die
Sequenz wurde inseriert unter Verwendung des Sense-Oligonucleotids
pYIGSRs (d. h. umfassend die Sequenz CT AGT GGA TAC ATC GGC AGT
CGC GGT TAC ATT GGG TCC CGA GGA TAT ATA GGC TCA AGA T [SEQ ID NO:64])
und des Antisense-Oligonucleotids pYIGSRs (d. h. umfassend die Sequenz
CT AGA TCT TGA GCC TAT ATA TCC TCG GGA CCC AAT GTA ACC GCG ACT GCC
GAT GTA TCC A [SEQ ID NO:65]).
-
Das
resultierende Plasmid enthält
das Targeting-Motiv YIGSR [SEQ ID NO:66] (d. h. umfassend die Sequenz
Tyr Ile Gly Ser Arg [SEQ ID NO:66]), welches mit submillimolarer
Affinität
an den Hochaffinitätsrezeptor
Laminin bindet. Das Motiv YIGSR [SEQ ID NO:66], welches als YIGSRG
präsent
ist (d. h. umfassend die Sequenz Tyr Ile Gly Ser Arg Gly [SEQ ID
NO:67]), ist dreimal wiederholt in jedem Fiber-Monomer, so dass
sich insgesamt 9 Motive pro Fiber-Molekül ergeben. Insbesondere stellt
das Motiv YIGSR [SEQ ID NO:66] Targeting auf den 67 kDA-Laminin/Elastin-Rezeptor
bereit. Dieser Rezeptor ist präsent
in Monocyten/Neutrophilen, glatten Gefäßmuskeln, Fibroblasten und
Chondrocyten und ist in vielen Tumoren aufreguliert. Ferner scheint der
Rezeptor involviert in Tumormetastasierung und Angiogenese. Typische
Liganden für
den Laminin/Elastin-Rezeptor umfassen Laminin, Elastin und Galactose.
Das hierin abgeleitete Plasmid p193(F5)pYIGSR wurde ferner für die Generierung
des Adenovirus-Vektors AdZ.pYIGSR verwendet.
-
Dieses
Beispiel bestätigt
somit, dass andere Oligonucleotide verwendet werden können zum
Inserieren einer nicht-nativen Aminosäuresequenz in ein Fiberprotein.
Derartige Insertionen können
entweder in einer exponierten Schleife des Adenovirus-Fiber-Knob
oder, wie im Folgenden beschrieben, am C-Terminus des Fiberproteins
durchgeführt
werden. Ferner kann die nicht-native Aminosäuresequenz in das chimäre Fiberprotein
nicht nur als eine Insertion in die Sequenz inkorporiert werden,
sondern auch als ein Austausch von adenoviralen Sequenzen. Dies
kann durchgeführt
werden durch einfache Modifikation der hierin beschriebenen Klonierungsprozeduren,
wie sie dem Fachmann bekannt sind.
-
Beispiel 9
-
Dieses
Beispiel beschreibt die Charakterisierung von adenoviralen Vektoren,
welche Fiber-Sequenzen codieren, die eine Insertion eines eingeschränkten RGD-Peptidmotivs
am C-Terminus des Adenovirus-Fiberproteins aufweisen. Insbesondere
wurden diese Vektoren auf ihre Fähigkeit,
aktive Viruspartikel in verschiedenen Zellen zu produzieren, untersucht.
-
Für die Western-Analyse
von Viruspartikeln wurden gereinigte Viruspartikel (2 × 1010) in einem Volumen von 10 μl 1:1 in
Laemmli-Laufpuffer verdünnt
und auf ein Gel mit 9% Acrylamid, enthaltend 0,1% SDS, geladen.
Das Gel wurde bei 150 mV laufen gelassen und dann auf Nitrocellulose
transferiert. Die Nitrocellulose wurde mit 5% Trockenmilch blockiert
und mit einer Kombina tion von polyklonalen Kaninchen-Antikörpern sondiert,
die gegen denaturierte Ad5-Virionen (1:1000) und gegen Fiberprotein
(1:5000) gerichtet sind. Die Proteine wurden mittels anti-Kaninchen-Peroxidase
(1:5000) und eines kommerziell erhältlichen Chemilumineszenz-Detektionskit
detektiert.
-
Die
Fiberproteine der rekombinanten Adenoviren AdZ.pGS und AdZ.RGD waren
auf dem Western relativ zu dem in dem AdZ-Vektor enthaltenen Fiberprotein
nach oben verschoben. Ein parallel laufen gelassenes Gel, welches
auf Nitrocellulose transferiert und nur mit dem gegen das Fiberprotein
gerichteten polyklonalen Antikörper
sondiert wurde, demonstrierte, dass die verschobenen Banden in der
Western-Analyse in der Tat Fiberprotein waren. Diese Resultate bestätigen, dass
die AdZ.pGS- und AdZ.RGD-Fiberproteine die geeigneten Aminosäure-Inserte
enthalten.
-
Die
Kinetik der Virusproduktion wurde bestimmt, um zu bestätigen, dass
lebensfähiges
Adenovirus in 293-Zellen produziert wurde, welche mit verschiedenen
adenoviralen Vektoren gemäß der Erfindung
infiziert waren. Zur Durchführung
dieser Studien wurde radiomarkiertes Adenovirus hergestellt durch
Zugabe von 50 μCi/ml
[3H]-Thymidin (Amersham, Arlington Heights,
IL) zu dem Medium von infizierten Zellen 20 Stunden nach ihrer Infektion
bei einem MOI-Wert von 5. Die infizierten Zellen wurden dann 60
Stunden post Infektion geerntet und das Virus wurde gereinigt, wie
früher
beschrieben. Die Aktivität
der markierten Viren betrug ca. 104 Viruspartikel/cpm.
Infektiöse
Partikel wurden in Fluoreszenz-Fokuseinheiten (ffu) mittels eines
Fluoreszenz-Fokus-Assay
auf 293-Zellen titriert.
-
Die
Kinetik der Produktion aktiver Viruspartikel aus infizierten 293-Zellen
wurde bestimmt durch Infizieren von 106 293-Zellen
mit 0,2 ml AdZ oder AdZ.RGD für
1 Stunde in 6 cm-Platten bei einem MOI-Wert von 10 am Tag 0. Die
Zellen wurden am Tag 1, 2 und 3 post Infektion geerntet. Die Zellen
wurden herunterzentrifugiert und resuspendiert in 1 ml PBS für AdZ und
AdZ.RGD. Die Zellen wurden dreimal eingefroren und aufgetaut, um
die Viruspartikel freizusetzen. Die Lysate wurden dann auf die Anzahl
der pro Zelle produzierten aktiven Partikel mittels Standard-Techniken
getestet. Die Resultate dieser Experimente (in 11 dargestellt) bestätigen, dass die Modifi kationen
des Fiberproteins in AdZ.RGD die Produktion von aktiven Viruspartikeln nicht
signifikant beeinflussen, verglichen mit dem unmodifizierten Vektor
AdZ.
-
Ähnlich wurde
die Partikeldosis-Antwort der Vektoren AdZ und AdZ.RGD auf A549-Epithel-,
CPAE-Endothel- und humanen intestinalen glatten Muskel(HISM-)Zellen
untersucht. HISMC-, CPAE- oder A549-Zellen (5 × 105 Zellen/Well)
wurden 1 bis 2 Tage vor den Experimenten auf 6 cm-Platten ausgesät. In Assays
zum Evaluieren der Vektordosis-Antwort in Fiber-Rezeptor exprimierenden
Zellen wurden ansteigende Konzentrationen von AdZ- oder AdZ.RGD-Partikeln
mit den Zellen für
60 Minuten bei 37°C
in 0,2 ml DMEM + 20 mM HEPES inkubiert. Die Platten wurden alle
10 Minuten während
dieser Inkubation geschüttelt.
Die Zellen wurden dann zweimal mit DMEM gewaschen und in DMEM +
5% Kälberserum
für 2 bis
3 Tage bei 37°C
kultiviert. Das Medium wurde dann abgesaugt, und die Zellen wurden
in 1 ml 1X-Reporter-Lyse-Puffer
+ 10 mM EDTA (Promega, Madison, WI) lysiert. Die β-Galactosidase-Aktivität in den
Zelllysaten wurde sodann bestimmt, wie früher beschrieben. Die Resultate
sind Mittelwerte von Duplikatmessungen.
-
Die
Resultate dieser Experimente sind in den 12–14 präsentiert.
Diese Experimente bestätigen,
dass die AdZ- und AdZ.RGD-Vektoren äquivalent sind mit Bezug auf
ihre Fähigkeit
zum Eintritt und zur Produktion von lebensfähigen Viruspartikeln in Zellen
(A549), die bekanntermaßen
hohe Levels von Adenovirus-Fiber-Rezeptor exprimieren (d. h. A549-Zellen,
wie in 12 präsentiert). Für die (in 13 bzw. 14 präsentierten)
CPAE- und HISM-Zellen jedoch, denen signifikante Levels von Adenovirus-Fiber-Rezeptor
fehlen, die aber αV-Integrine exprimieren, ist der AdZ.RGD-Vektor
viel effizienter in der Transduktion als der unmodifizierte AdZ-Vektor.
Die Transduktion der CPAE- und HISM-Zellen durch AdZ.RGD ist etwa
100fach bzw. 30fach höher
als bei AdZ über
einen weiten Bereich von Vektor-Konzentrationen.
-
Dieses
Resultate validieren, dass Aminosäure-Inserte, welche in adenoviralen
Vektoren gemäß der Erfindung
präsent
sind, geeignet translatiert werden im Kontext des chimären Adenovirus-Fiberproteins
und dass das resultierende Fiberprotein funktional ist, wie abgeschätzt durch
die Generierung von lebens fähigen Adenoviren,
welche dieses Protein enthalten. Ferner bestätigen die Resultate, dass das
in dem chimären
Fiberprotein präsente
Peptidmotiv in der Lage ist, Adenovirus-Bindung umzudirigieren und
adenovirale Zellbindung/-eintritt mit einer hohen Effizienz selektiv
zu bewirken.
-
Beispiel 10
-
Dieses
Beispiel beschreibt das Bindungsverhalten von adenoviralen Vektoren,
welche Fiber-Sequenzen codieren, die eine Insertion eines eingeschränkten Peptidmotivs
am C-Terminus des Adenovirus-Fiberproteins aufweisen.
-
Die
Spezifität
der Vektoren AdZ und AdZ.RGD bei der Bindung an Nieren(835)-, Glattmuskel-(A10)- und
Endothel-(CPAE)-Zellen wurde untersucht. Für diese Experimente wurden
Monolayer von 835-, A10- oder CPAE-Zellen in 24-Well-Gewebekulturplatten für 45 Minuten
mit 0,3 ml Medium, welches lösliche
rekombinante Fiber (F5; 3 μg/ml),
Pentonbasis (PB; 50 μg/ml),
Fiber plus Pentonbasis oder keines der Coat-Proteine, enthielt,
vorinkubiert. Radiomarkierter AdZ oder AdZ.RGD wurde sodann zu den
Wells hinzugegeben und für
90 Minuten unter Hin- und Herbewegen bei Raumtemperatur inkubiert.
Die Wells wurden dreimal mit PBS gewaschen, und die verbliebene
zellassoziierte Radioaktivität
wurde in einem Szintillationszähler
bestimmt. Die Resultate dieser Experimente sind graphisch in den
15–
17 und
quantitativ in Tabelle 3 präsentiert. Tabelle 3 Vergleich der AdZ- und AdZ.RGD-Bindung
an drei Zelllinien*
| | 835-HEK** | CPAE** | A10** |
| | AdZ | AdZ.RGD | AdZ | AdZ.RGD | AdZ | AdZ.RGD |
| Kontrolle | 7,6 | 12,7 | 0,19 | 0,84 | 0,72 | 1,68 |
| Fiber | 1,7 | 12,3 | 0,22 | 1,06 | 0,23 | 1,40 |
| PB | 9,0 | 9,7 | 0,20 | 0,37 | 0,80 | 0,62 |
| Fiber/PB | 1,0 | 3,7 | 0,21 | 0,46 | 0,20 | 0,41 |
- Werte repräsentieren den Prozentsatz an
Input-Vektor im Bindungsassay.
- **Fehler für
alle Werte unter 10%.
-
Diese
Resultate bestätigen,
dass sowohl für
die 835-Zellen (15) als auch für die A10-Zellen (16) Fiberprotein die AdZ-Transduktion signifikant
blockiert, nicht aber die AdZ.RGD-Transduktion. Nur Fiber plus Pentonbasis,
welches – in
Kombination – sowohl
Fiber-Rezeptor als auch αV-Integrine blockiert, ist in der Lage, die
Bindung von AdZ.RGD an diese Zellen signifikant zu blockieren. Für die CPAE-Zellen,
denen detektierbare Levels an Fiber-Rezeptor fehlen (17), ist Pentonbasis allein in der Lage, die Bindung
von AdZ.RGD signifikant zu blockieren.
-
Diese
Resultate demonstrieren, dass AdZ.RGD mit αV-Integrinen
auf Zellen interagiert. Ferner validieren die Resultate, dass das
Peptidmotiv, wie es in dem Fiberprotein von AdZ.RGD präsent ist,
effektiv verwendet werden kann, um Adenovirus auf bestimmte Zellen
zielzusteuern.
-
Beispiel 11
-
Dieses
Beispiel beschreibt Gen-Delivery, welches durch adenovirale Vektoren
vermittelt wird, die Insertionen von verschiedenen Sequenzen am
C-Terminus des Adenovirus-Fiberproteins codieren.
-
Zum
Testen der Fähigkeit
des Peptidmotivs YIGSR [SEQ ID NO:66], Zell-Targeting zu bewirken,
wurden A549-Zellen für
30 Minuten in der Anwesenheit und in der Abwesenheit von kompetierendem
Wildtyp-Fiberprotein vorinkubiert. Gereinigte AdZ- oder AdZ.pYIGSR-Vektoren
wurden sodann mit den Zellen für
weitere 60 Minuten bei 37°C
inkubiert. Die Zellen wurden dann dreimal mit PBS gewaschen und über Nacht
in Kulturmedium inkubiert. Aus den lysierten Zellen wurde die β-Galactosidase-Aktivität bestimmt.
-
18 zeigt, dass das rekombinante Wildtyp-Fiberprotein
das Gen-Delivery durch beide Vektoren komplett blockierte. Erhöhtes Gen-Delivery
durch den AdZ.pYIGSR-Vektor wird in der Anwesenheit von Fiberprotein
nicht beobachtet. Dies zeigt, dass das pYIGSR-Targeting-Motiv nicht
von ausreichend hoher Affinität ist,
um den Block der Adenovirus-Bindung zu überwinden, der mit der Zugabe
löslichen
Fiberproteins erzielt wird.
-
Zum
Testen der Fähigkeit
des pLDV-Motivs, Zell-Targeting zu bewirken, wurden Ramos-Zellen
(welche hohe Levels des α4-Integrin-Zielrezeptors exprimieren) für 30 Minuten
in der Anwesenheit und in der Abwesenheit von kompetierendem Wildtyp-Fiberprotein
vorinkubiert. Die gereinigten AdZ- oder AdZ.pLDV-Vektoren wurden
sodann mit den Zellen für
weitere 60 Minuten bei 37°C
inkubiert. Die Zellen wurden dreimal mit PBS gewaschen und über Nacht
in Kulturmedium inkubiert. Sodann wurde aus den lysierten Zellen
die β-Galactosidase-Aktivität bestimmt.
-
19 illustriert durch den AdZ.pLDV-Vektor bewirktes
Gen-Delivery in Ramos-Zellen. Wie aus dieser Figur ersichtlich,
blockierte das rekombinante Wildtyp-Fiberprotein sowohl das Gen-Delivery
durch AdZ als auch das Gen-Delivery
durch AdZ.pLDV. Wie bei AdZ.pYIGSR kann kein gesteigertes Gen-Delivery, bewirkt durch
den AdZ.pLDV-Vektor, in der Gegenwart von Fiberprotein, nachgewiesen
werden. Dies zeigt, dass das pLDV-Targeting-Motiv – wie das
Targeting-Motiv YIGSR [SEQ ID NO:66] – nicht von ausreichend hoher
Affinität ist,
um den Fiber-vermittelten Block der Proteinbindung zu überwinden.
Die verbliebene Gen-Delivery-Kapazität von AdZ.pLDV, die nicht durch
die Zugabe von löslichem
Fiberprotein blockiert wird, wird auch durch weitere Inkubation
mit EDTA nicht blockiert. Im Vergleich dazu wird die Interaktion
der α4-Integrine mit dem LDV-Motiv, welches normalerweise
in Fibronectin präsent
ist, durch EDTA blockiert. Dieses Resultat bestätigt ferner, dass das pLDV-Targeting-Motiv
nicht mit ausreichend hoher Affinität mit α4-Integrinen
interagiert, um Vektorbindung und Gen-Delivery in die Ramos-Zellen
zu erhöhen.
Jedoch ist es sowohl mit dem YIGSR-Motiv (d. h. umfassend die Sequenz
[SEQ ID NO:66]) als auch mit dem LDV-Motiv möglich, dass Hochaffinitäts-Peptidmotive abgeleitet
werden könnten
durch die konformationelle Beschränkung dieser Peptide in einer
exponierten Schleife der Fiberproteine.
-
Die
Fähigkeit
des RGD-Motivs, Zell-Targeting zu bewirken, wurde ähnlich bei αv-Integrine
exprimierenden 293-Zellen studiert. Diese Studien wurden wie für die anderen
Peptidmotive/Zelllinien durchgeführt.
Jedoch wurden zu Vergleichszwecken ferner die Vektoren AdZ und AdZ.pRGD
(d. h. der Vektor, wel cher multiple Kopien des RGD-Motivs enthält, das
keine Cystein-Reste aufweist) einbezogen. Die Ergebnisse dieser
Studien sind in 20 präsentiert. Wie aus dieser Figur
ersichtlich, war AdZ.RGD, nicht aber AdZ.pRGD, klar in der Lage,
den Fiber-vermittelten Block des adenoviral vermittelten Gen-Delivery
zu überwinden.
-
Diese
Resultate bestätigen
somit, dass das RGD-Peptidmotiv (d. h. präsent als eine Schleife am C-Terminus
des Fiberproteins) – wie
das in einer Schleife des Adenovirus-Fiberproteins präsente RKKK2-Motiv
(in Beispiel 4 beschrieben) – von
ausreichend hoher Affinität
ist, so dass es in der Lage war, den Fiber-vermittelten Block des
adenoviral vermittelten Gen-Delivery zu überwinden und effektiv die
typische Interaktion von Wildtyp-Fiberprotein mit seinem zellulären Rezeptor
zu "verdrängen", um das Adenovirus
auf einen neuen Rezeptor zielzusteuern.
-
Die
Resultate bestätigen
weiter, dass die Einschränkung
einer nicht-nativen Aminosäuresequenz
(d. h. entweder durch Insertion in eine Fiber-Schleife oder durch
Erzeugung einer schleifenähnlichen
Struktur am Fiber-Terminus) in der Erzeugung eines Hochaffinitäts-Peptidmotivs
resultieren kann. Ein derartiges Hochaffinitäts-Peptidmotiv kann für adenovirales
Zell-Targeting Anwendung finden.
-
Die
Erfindung wurde mit Betonung auf bevorzugte Ausführungsformen beschrieben; für den Durchschnittsfachmann
wird jedoch erkennbar sein, dass Variationen der bevorzugten Ausführungsformen
hergestellt und verwendet werden können und dass die Erfindung
auch anders als spezifisch hierin beschrieben umgesetzt werden kann.
Es ist beabsichtigt, dass die vorliegende Erfindung derartige Variationen
und alternative Umsetzungen mit umfasst. SEQUENZLISTE